
| A、[Abc]5g18s2 |
| B、[Abc]8s28p1 |
| C、[Abc]7d18s2 |
| D、[Abc]6f18s2 |
| E、[Abc]6f18s2 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、22.86 |
| B、11.43 |
| C、80.01 |
| D、160.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
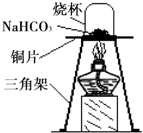 碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.| 实 验 操 作 | 预期实验现象 | 结 论 |
| 固体产物是Na2CO3,而不是NaOH. | ||
| 固体产物是NaOH,而不是Na2CO3. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2 |
| B、CH4 |
| C、CO |
| D、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | |
| 铝热剂质量/g | 7.5 | 18.0 | 20.0 |
| 气体体积/L | 3.36 | 6.72 | 6.72 |
查看答案和解析>>
科目:高中化学 来源: 题型:
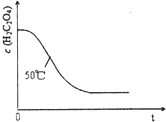
| 实验编号 | 温度(℃) | 催化剂 用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究 b.实验1和3探究反应物浓度对该反应速率的影响; c.实验1和4探究催化剂对该反应速率的影响. | |
| 体积 (mL) | 浓度 (mol?L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com