
某溶液中可能含有H+、NH 、Mg2+、Al3+、Fe3+、CO
、Mg2+、Al3+、Fe3+、CO 、SO
、SO 、NO
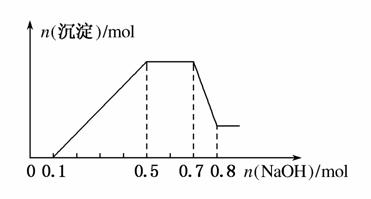
、NO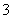 中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )
中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )
A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中n(NH )=0.2 mol
)=0.2 mol
C.溶液中一定不含CO ,可能含有SO
,可能含有SO 和NO
和NO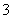
D.n(H+):n(Al3+):n(Mg2+)=1:1:1
解析 加锌粒产生无色无味的气体,说明Zn与H+反应生成H2,溶液中有大量H+,故溶液中没有CO 和NO
和NO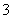 ,C项错误。根据图象可知,加入NaOH溶液,第一阶段与H+反应,第二阶段与Mg2+、Al3+反应生成白色Mg(OH)2、Al(OH)3沉淀,第三阶段与NH
,C项错误。根据图象可知,加入NaOH溶液,第一阶段与H+反应,第二阶段与Mg2+、Al3+反应生成白色Mg(OH)2、Al(OH)3沉淀,第三阶段与NH 反应得到NH3·H2O,第四阶段与Al(OH)3反应生成偏铝酸钠,随后不再发生反应,第三阶段消耗NaOH的物质的量为0.7 mol-0.5 mol
反应得到NH3·H2O,第四阶段与Al(OH)3反应生成偏铝酸钠,随后不再发生反应,第三阶段消耗NaOH的物质的量为0.7 mol-0.5 mol =0.2 mol,所以溶液中n(N
=0.2 mol,所以溶液中n(N H
H )=0.2 mol,B项正确。溶液中的阳离子一定有NH
)=0.2 mol,B项正确。溶液中的阳离子一定有NH 、H+、Mg2+、Al3+,A项错误。第一阶段消耗NaOH的物质的量为0.1 mol,所以n(H+)=0.1 mol,第四阶段发生反应:Al(OH)3+OH-===AlO
、H+、Mg2+、Al3+,A项错误。第一阶段消耗NaOH的物质的量为0.1 mol,所以n(H+)=0.1 mol,第四阶段发生反应:Al(OH)3+OH-===AlO +2H2O,
+2H2O, 消耗氢氧化钠的物质的量为:0.8 mol-0.7 mol=0.1 mol,n[Al(OH)3]=0.1 mol,故n(Al3+)=n[Al(OH)
消耗氢氧化钠的物质的量为:0.8 mol-0.7 mol=0.1 mol,n[Al(OH)3]=0.1 mol,故n(Al3+)=n[Al(OH) 3]=0.1 mol,第二阶段发生反应:Al3++3OH-===Al(OH)3↓、Mg2++2OH-===Mg(OH)2↓,0.1 molAl3+消耗NaOH的物质的量是0.3 mol,所以Mg2+消耗氢氧化钠的物质的量是0.5 mol-0.1 mol-0.3 mol=0.1 mol,所以n(Mg2+)=0.05 mol,故n(H+):n(Al3+):n(Mg2+) =0.1:0.1:0.05=2:2:1,D项错误。
3]=0.1 mol,第二阶段发生反应:Al3++3OH-===Al(OH)3↓、Mg2++2OH-===Mg(OH)2↓,0.1 molAl3+消耗NaOH的物质的量是0.3 mol,所以Mg2+消耗氢氧化钠的物质的量是0.5 mol-0.1 mol-0.3 mol=0.1 mol,所以n(Mg2+)=0.05 mol,故n(H+):n(Al3+):n(Mg2+) =0.1:0.1:0.05=2:2:1,D项错误。
答案 B


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
烷烃A只可能有三种一氯取代物B、C和D,C的结构简式是(CH3)2CCH2CH3CH2Cl,B和D分别与强
碱的醇溶液共热,都只能得到有机化合物E。以上反应及B的进一步反应如下所示。

请回答下列问题:
(1)A的结构简式是___________________________________________________。
(2)H的结构简式是___________________________________________________。
(3)B转化为F的反应属于____________反应(填反应类型名称)。
(4)B转化为E的反应属于____________反应(填反应类型名称)。
(5)写出下列物质间转化的化学方程式
①B→F:________________________________________________________________。
②F→G:________________________________________________________________。
③D→E:________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:
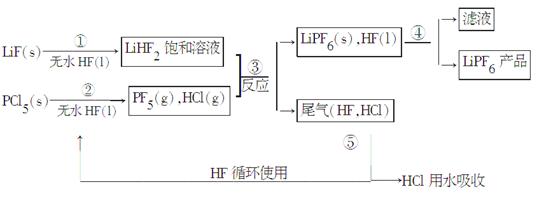
已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。
(1)第①步反应中无水HF的作用是_______、________。反应设备不能用玻璃材质的原因是________________________(用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的________溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:
__________________________________________________________。
(3)第④步分离采用的方法是__________________;第⑤步分离尾气中HF、HCl采用的方法是__________________________________。
(4)LiPF6产品中通常混有少量LiF。取样品w g,测得Li的物质的量为n mol,则该样品中LiPF6的物质的量为________mol(用含w、 n的代数式表示)。
n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
ClCH2COONa是合成一种除草剂的重要原料,其制备过程如下:
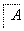
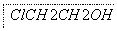
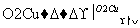
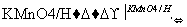
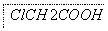
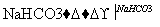
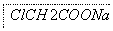
请回答下列问题:
(1)已知烃A的相对分子质量为28,则其分子式为________,反应①的有机反应类型为________。
(2)烃A在一定条件下发生聚合反应可生成高分子化合物,反应的化学方程式为____________________________________________________。
(3)反应②类似于乙醇的催化氧化,反应的化学方程式为
___________________________________________________________。
(4)在浓硫酸的作用下,ClCH2CH2OH与ClCH2COOH可发生反应,该反应类似于乙醇与乙酸的酯化反应,反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有气体产生的化学实验中,某段时间内气流速率可能过快,这极有可能导致实验不能顺利进行,甚至会引起危险。下列实验装置可使反应顺利进行或能有效保证实验安全的是( )
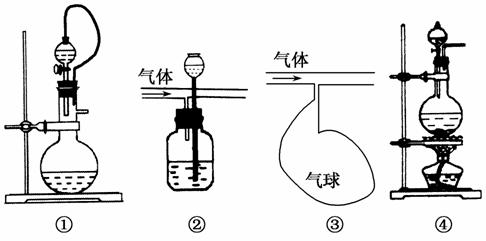
A.①②④ B.①②③
C.②③④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A.质子数:c>d B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ D.原子半径:X<W
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Co2O3在酸性溶液中易被还原成Co2+,且Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列叙述中,正确的是:
A.Cl2通入FeI2溶液中,可存在反应3Cl2+6FeI2=2FeCl3+4FeI3
B.每1 mol Co2O3在酸性溶液中被氧化生成Co2+时转移2 mol e-
C.FeCl3溶液能使淀粉- KI试纸变蓝
D.I2具有较强的氧化性,可以将Co2+氧化成Co2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高正价和最低负价之和为0;Z的非金属性在同周期元素中最强。下列说法正确的是
A.对应气态氢化物的稳定性:Y>Z
B.化合物XZW既含离子键也含共价键
C.对应简单离子半径:W>X
D.Y的氧化物能与Z或X的最高价氧化物对应的水化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
氧气(O2)和臭氧(O3)是氧元素的两种同素异形体,已知热化学方程式:
4Al(s)+3O2(g)===2Al2O3(s) ΔH1 ①
4Al(s)+2O3(g)===2Al2O3(s) ΔH2 ②
3O2(g)===2O3(g) ΔH3 ③
则 ( )
A.ΔH1-ΔH2=ΔH3 B.ΔH1+ΔH2=ΔH3
C.ΔH2-ΔH1=ΔH3 D.ΔH1+ΔH2+ΔH3=0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com