
【题目】CO2的资源化利用是解决温室效应的重要途径,如图是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应: 
下列有关三聚氰酸的说法正确的是( )
A.分子式为C3H6N3O3
B.分子中既含极性键,又含非极性键
C.属于共价化合物
D.生成该物质的上述反应为中和反应
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.糖类在一定条件下都可以水解
B.除去油脂中的少量水分,既可以用无水硫酸钠也可以用碱石灰
C.酒中存在的某些微生物可以使部分乙醇发酵,氧化为碳酸,酒就有了酸味
D.氨基酸分子中含有—COOH和—NH2二种原子团,氨基酸分子之间能相互形成复杂的多肽化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据,下列说法正确的是
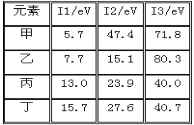
A. 甲的金属性比乙弱
B. 乙的化合价为+1价
C. 丙一定为非金属元素
D. 丁一定是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、T、W五种元素的性质或原子结构如下表:
元素 | 元素性质或原子结构 |
X | 原子的最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 基态原子最外层电子排布式为(n+1)sn(n+1)pn+2 |
T | 与Z同周期,元素最高价是+7价 |
W | 原子序数为Y、T元素之和,不锈钢中含有该元素 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是;W元素基态原子电子排布式为 .
(2)元素Z与元素T相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是 . A.常温下Z的单质和T的单质状态不同
B.T的氢化物比Z的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
D.T的电负性比Z大
(3)常见溶剂XZ2的分子中,含有的σ键与π键个数比为 , 它所形成的晶体类型为; Y的常见氢化物易液化的主要原因是
(4)①自然界常见的X元素含氧酸的钙盐和适量T的氢化物溶液反应时,每产生4.4g 气体(不考虑气体溶解)放热a kJ,则该反应的热化学方程式为 . ②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示
请用离子方程式表示BC段、CD段发生的反应:
BC段:;
CD段: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨在材料领域有重要应用,某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,设计的提纯与综合利用工艺如下:
(注:SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃)
(1)向反应器中通入Cl2前,需通一段时间N2 , 主要目的是 .
(2)高温反应后,石墨中氧化物杂质均转变为相应的氯化物,气体I中的碳氧化物主要为 , 由气体Ⅱ中某物质得到水玻璃的化学反应方程式为 .
(3)步骤①为:搅拌、、所得溶液IV中的阴离子有 .
(4)由溶液Ⅳ生成沉淀Ⅴ的总反应的离子方程式为 ![]() , 100kg初级石墨最多可获得V的质量为kg.
, 100kg初级石墨最多可获得V的质量为kg.
(5)石墨可用于自然水体中铜件的电化学防腐,完成图2防腐示意图,并作相应标注.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质.)
(1)Ⅰ、把与下面的元素有关性质相符的曲线的标号填入相应括号中:a.ⅡA族元素的最外层电子数 .
b.第三周期元素的最高化合价 .
c.第三周期离子Na+、Mg2+、Al3+、P3﹣、S2﹣、Cl﹣的离子半径 .
d.第二、三周期元素随原子序数递增原子半径的变化 .
(2)Ⅱ、有下列物质:① ![]() C;②
C;② ![]() K;③
K;③ ![]() Ca;④
Ca;④ ![]() C;⑤
C;⑤ ![]() N;⑥
N;⑥ ![]() Ar.其中: a.互为同位素的是 .
Ar.其中: a.互为同位素的是 .
b.质量数相等,但不能互称同位素的是 .
c.中子数相等,但质子数不相等的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7),工艺流程及相关物质溶解度曲线如图:
(1)由Na2Cr2O7生产K2Cr2O7的化学方程式为 , 通过冷却结晶析出大量K2Cr2O7的原因是 .
(2)向Na2Cr2O7母液中加碱液调pH的目的是 .
(3)固体A主要为(填化学式),固体B主要为(填化学式).
(4)用热水洗涤固体A,回收的洗涤液转移到母液(填“Ⅰ”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗最低.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 . 一种工业合成氨的简式流程图如下: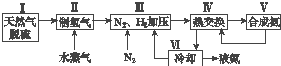
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS.一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:
(2)步骤Ⅱ中制氢气的原理如下:①CH4(g)+H2O(g)CO(g)+3H2(g)△H=+206.4 kJmol﹣1
②CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41.2kJmol﹣1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 .
a.升高温度b.增大水蒸气浓度 c.加入催化剂d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量.若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18mol CO、CO2和H2的混合气体,则CO的转化率为 .
(3)图(a)表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系.根据图中a点数据计算N2的平衡体积分数: .
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图 . 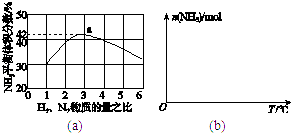
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号) . 简述本流程中提高合成氨原料总转化率的方法:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列四种化合物溶于稀盐酸,滴加硫氰化钾溶液,没有颜色变化,再加氯水即呈现血红色的是
A. FeOB. Fe2O3
C. FeCl3D. Fe2(SO4)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com