
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n( N2) | 0 | 0.20 | 0.35 | 0.40 | 0.40 |
| T2 | n( N2) | 0 | 0.25 | … | 0.30 | 0.30 |
| A. | 10min内,T1时的v(N2)比T2时的小 | |
| B. | T1<T2 | |
| C. | a<0 | |
| D. | T2时,若向平衡后的容器中再充入1.2molCH4,重新达到平衡时n(N2)=0.40mol |
分析 A.由表格中的数据计算υ(N2);
B.温度升高,反应速率加快;
C.温度升高,氮气的量增多,说明反应向右进行,正反应吸热;
D.T2时平衡常数来求解.
解答 解:A.10 min内,T1时υ( N2)=$\frac{\frac{0.20mol}{1L}}{10min}$=0.02mol•L-1•min-1,T2时时υ( N2)=$\frac{\frac{0.25mol}{1L}}{10min}$=0.025mol•L-1•min-1,T1时υ(N2)比T2时小,故A正确;
B.温度升高,反应速率加快,因此T2>T1,故B正确;
C.温度升高,氮气的量减少,说明反应逆向进行,正反应放热,所以a<0,故C正确;
D. CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g);
初起量:0.50 1.2 0 0 0
变化量:0.30 0.60 0.30 0.30 0.60
平衡量:0.20 0.60 0.30 0.30 0.60
所以T2时平衡K=$\frac{0.30×0.30×0.60{\;}^{2}}{0.20×0.6{0}^{2}}$=0.45,
CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g);
初起量:1.40 0.60 0.30 0.30 0.60
变化量:x 2x x x 2x
平衡量:1.4-x 0.60-2x 0.30+x 0.30+x 0.60+2x
所以:$\frac{(0.30+x)×(0.30+x)×(0.60+2x)^{2}}{(1.4-x)×(0.60-2x)^{2}}$=0.45,将x=0.1带入不成立,故D错误;
故选D.
点评 本题主要考查外界条件对化学反应速率以及平衡移动原理及其应用,难度中等以上,注意灵活运用所学知识.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物(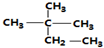 )的名称为2-甲基-2-乙基丙烷 )的名称为2-甲基-2-乙基丙烷 | |
| B. | 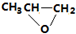 和CO2转化为 和CO2转化为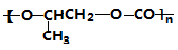 的反应符合绿色化学的原则 的反应符合绿色化学的原则 | |
| C. | 用新制氢氧化铜悬浊液无法检验失去标签的乙醇、乙醛、乙酸三瓶无色溶液 | |
| D. | 乙醇和乙醚互为同分异构体,沸点乙醇比乙醚高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
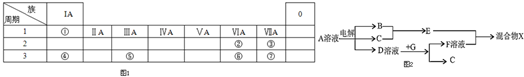
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图装置中,容器甲内充入0.1mol NO气体.干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加了2.24g.随着CO2的继续通入,活塞又逐渐向右移动.下列说法中正确的是( )
如图装置中,容器甲内充入0.1mol NO气体.干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加了2.24g.随着CO2的继续通入,活塞又逐渐向右移动.下列说法中正确的是( )| A. | 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L (标准状况) | |
| B. | NO2转化为N2O4的转化率为20% | |
| C. | 容器甲中NO已反应完 | |
| D. | 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得的分散系属于胶体,可发生丁达尔效应 | |
| B. | 所得的分散系中,分散质的主要成分为FeO | |
| C. | 该分散系进行电泳实验时,阳极周围黑色加深 | |
| D. | 往油酸钠水溶液中滴加浓溴水振荡,无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $\stackrel{KMnO_{4}/H+}{→}$RCOOH+
$\stackrel{KMnO_{4}/H+}{→}$RCOOH+
 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +H2O
+H2O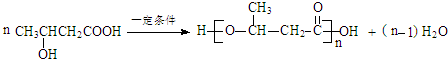 .
. .
.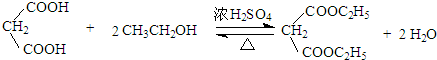 .
.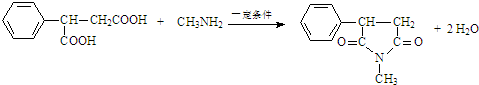 .
.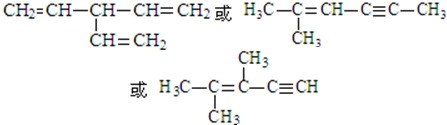 (写出一种即可).
(写出一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
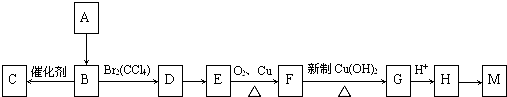
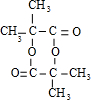 .
. ;E→F:2(CH3)2C(OH)-CH2OH+O2$→_{△}^{Cu}$2(CH3)2C(OH)-CHO+2H2O.
;E→F:2(CH3)2C(OH)-CH2OH+O2$→_{△}^{Cu}$2(CH3)2C(OH)-CHO+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于有气体参与的化学平衡体系,增大压强,反应速率一定加快 | |
| B. | 常温下,反应4Fe(OH)2(S)+2H2O(l)+O2(g)=4Fe(OH)3(S)的△H<0,△S<0 | |
| C. | 用0.1mol/L醋酸滴定0.lmol/L NaOH溶液至中性时:c(CH3COO -)+c(CH3COOH)<c(Na+) | |
| D. | 向纯水中加入盐类物质,有可能促进水的电离平衡,但不可能抑制水的电离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com