
| A. | ①② | B. | ②⑤ | C. | ③④ | D. | ②④ |
分析 ①弱电解质写化学式;
②铁跟稀盐酸反应生成亚铁离子和氢气;
③碘化钾溶液跟适量溴水反应转移电子不守恒;
④铁跟硫酸铜发生置换反应;
⑤碳酸氢钙溶液跟足量烧碱溶液反应生成碳酸钙、碳酸钠和水.
解答 解:①弱电解质写化学式,离子方程式为CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故错误;
②铁跟稀盐酸反应生成亚铁离子和氢气,离子方程式为Fe+2H+═Fe2++H2↑,故正确;
③碘化钾溶液跟适量溴水反应转移电子不守恒,离子方程式为2I-+Br2═2Br-+I2,故错误;
④铁跟硫酸铜发生置换反应,离子方程式为Cu2++Fe═Fe2++Cu,故正确;
⑤碳酸氢钙溶液跟足量烧碱溶液反应生成碳酸钙、碳酸钠和水,离子方程式为2HCO3-+Ca2++2OH-=CO32-+CaCO3↓+2H2O,故错误;
故选D.
点评 本题考查离子反应方程式的正误判断,明确发生的化学反应及离子反应的书写方法即可解答,离子方程式的书写要遵循电荷守恒、原子守恒、转移电子守恒,注意有些化学反应还与反应物的量有关,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
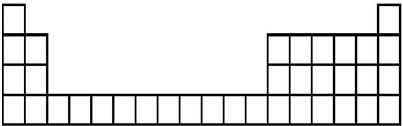
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 用浓硫酸配制一定物质的量浓度的硫酸溶液时,溶解后的溶液未冷却至室温就转移入容量瓶,会造成所配溶液浓度偏高 | |
| C. | 溶液加入稀盐酸产生无色气体,将气体通入澄清石灰水,变浑浊,原溶液一定含有CO32- | |
| D. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
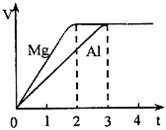 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,下列说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,下列说法正确的是( )| A. | 反应消耗镁、铝的物质的量之比是3:2 | |
| B. | 反应消耗镁、铝的质量之比是3:2 | |
| C. | 与镁和铝反应的硫酸的物质的量之比是3:2 | |
| D. | 与镁和铝反应的硫酸的质量之比是3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl晶体、BaSO4 | B. | Na2SO4、酒精 | ||
| C. | 铜、二氧化硫 | D. | 熔融的KNO3、硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
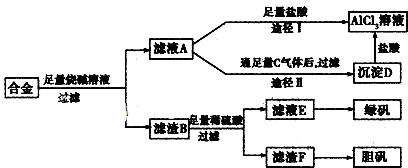

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com