
分析:H2O2与Fe2+在一定条件下都是既可作氧化剂,又可作还原剂的物质。本题可分别从它们作氧化剂或作还原剂的E0分析,便可得出结论。
解:H2O2还原剂时,
H2O2 - 2e- = 2H+ + O2;
H2O2作为氧化剂时,
H2O2 + 2H+ + 2e- = 2H2O
Fe2+ 亦可做还原剂,本身变为Fe3,也可作氧化剂,本身变为Fe。
假定H2O2作还原剂,Fe2+ 作氧化剂,应按下式进行反应:
H2O2 + Fe2+ = Fe + 2H+ + O2
从E0值分析:
2H+ + O2 + 2e- ![]() H2O2 E0 = +0.682 V
H2O2 E0 = +0.682 V
Fe2+ + 2e- ![]() Fe E0 = -0.44 V
Fe E0 = -0.44 V
显见 E![]() <E
<E![]() ,上述反应不能进行。
,上述反应不能进行。
再假定H2O2 氧化剂,Fe2+ 作还原剂,反应按下式进行:
2Fe2+ + H2O2 + 2H+ = Fe3+ + 2H2O
Fe3+ + e- ![]() Fe2 + E0 = +0.771 V
Fe2 + E0 = +0.771 V
2H+ + H2O2 + 2 e-![]() 2H2O E0 = +1.77 V
2H2O E0 = +1.77 V
显见 E![]() >E
>E![]() ,上述反应能自发进行。反应物是Fe3+ 和H2O。
,上述反应能自发进行。反应物是Fe3+ 和H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体).
下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体).
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
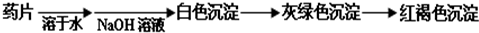
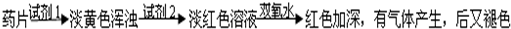
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 序号 | 实验设计 | 实验观察(主要现象) | 离子方程式 | 解释与结论 |
| ① | 在铁粉中滴 入稀硫酸 |
铁粉溶解,溶液由无 色变成浅绿色,有无 色无味的气体生成 |
Fe+2H+=H2↑+Fe2+ |
Fe具有还原性 |
② |
氯化亚铁溶液中滴入KSCN溶液,再加入氯水 | 滴入KSCN溶液无明 显变化,加入氯水立 即变成血红色 |
2Fe2++Cl2=2Fe3++2Cl-Fe3++3SCN-=Fe(KSCN)3 2Fe2++Cl2=2Fe3++2Cl-Fe3++3SCN-=Fe(KSCN)3 |
Fe2+具有还原性 Fe2+具有还原性 |
| ③ | 氯化亚铁溶液加 入锌片 |
锌片溶解,析出铁,溶液从浅绿色变为无色 锌片溶解,析出铁,溶液从浅绿色变为无色 |
Fe2++Zn=Fe+Zn2+ | Fe2+具有氧化性 Fe2+具有氧化性 |
④ |
在氯化铁溶液中加入KSCN溶液,再加入足量Cu片(或铁粉或锌片) 在氯化铁溶液中加入KSCN溶液,再加入足量Cu片(或铁粉或锌片) |
加入KSCN溶液出现血红色,加入足量Cu片(或铁粉或锌片)后血红色消失 加入KSCN溶液出现血红色,加入足量Cu片(或铁粉或锌片)后血红色消失 |
2Fe3++Cu=2Fe2++Cu2+或2Fe3++Fe=3Fe2+或2Fe3++Zn=2Fe2++Zn 2+或 2Fe3++3Zn=2Fe+3 Zn 2+ 2Fe3++Cu=2Fe2++Cu2+或2Fe3++Fe=3Fe2+或2Fe3++Zn=2Fe2++Zn 2+或 2Fe3++3Zn=2Fe+3 Zn 2+ |
Fe3+具有氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com