
����Ŀ��ijС��ͬѧ��̼��Ϊ�缫���CuCl2��Һʱ����������̼���ϳ����к�ɫ���������⣬����������ɫ����������Ϊ̽������̼���ϵIJ��ͬѧ���Ķ����ϲ���������¹��̣�
���й����ϣ�ͭ�Ļ�������ɫ��������
���� | ��ɫ������ | ���� | ��ɫ������ |
������ͭCu��OH��2 | ��ɫ���岻����ˮ | ����ͭ��CuSO4�� | ��Һ����ɫ |
������ͭ��Cu2O�� | ��ɫ���岻����ˮ | �Ȼ�ͭ��CuCl2�� | Ũ��Һ����ɫ��ϡ��Һ����ɫ |
�Ȼ���ͭ��CuCl�� | ��ɫ���岻����ˮ | ��ʽ�Ȼ�ͭ | ��ɫ���岻����ˮ |
��̽��ʵ�飺
��1��������裺
�ٺ�ɫ����һ����ͭ����������Cu2O��
�ڰ�ɫ����Ϊͭ�Ļ�����仯ѧʽ����Ϊ ��
��2��ʵ����֤��
ȡ���CuCl2��Һ�������̼����ϴ�ӡ������������װ�ý���ʵ�飬��֤�������
��ʵ��ǰ�����װ��A�����Եķ����� ��
��ʵ��ʱ����װ�ô������ҵ�����˳��ΪA������B����
��3���۲����ó�����
ʵ�������̼���ϵİ�ɫ���ʱ�Ϊ��ɫ��F�����ʲ���ɫ��D�г��ְ�ɫ���������������̼���ϵĺ�ɫ�����Ƿ���Cu2O����ǡ�������������
��װ��������ͼ��װ�ñ�ţ���������˵�����������еİ�ɫ����һ�����ڣ�
��д��װ��B�з�����Ӧ�Ļ�ѧ����ʽ ��
���𰸡�
��1��CuCl
��2���������ڵ������ϣ��õ��ɼмн��ܣ����Һ©����ע��ˮ����Һ©��������ˮ��Һ�治�������½���֤��װ��A�������Ժã�E��C��F��D
��3����F�����ʲ�����ɫ��D�����ְ�ɫ������2CuCl+H2 ![]() 2Cu+2HCl
2Cu+2HCl
���������⣺��1����Cu�Ļ��������ɫ��֪��CuClΪ��ɫ���壬���Դ��ǣ�CuCl����2��������װ�ò�©������װ�õ������ԣ��䷽��Ϊ�������ڵ������ϣ��õ��ɼмн��ܣ����Һ©����ע��ˮ����Һ©���Ļ�����ˮ��Һ�治�������½���֤��װ��A�������Ժã����Դ��ǣ��������ڵ������ϣ��õ��ɼмн��ܣ����Һ©����ע��ˮ����Һ©���Ļ�����ˮ��Һ�治�������½���֤��װ��A�������Ժã�����������ΪCu��������Cu2O��CuCl��������������E��ȥHCl������C���Ȼ��ͨ��B�з�Ӧ��ͨ��F�����Ƿ����Cu2O��������D���������ӣ���ȷ��˳��ΪA��E��C��B��F��D�����Դ��ǣ�E��C��F��D����3����������ˮ����ͭ����ɫ��֤��B�з�Ӧ����û��ˮ���ɣ�̼���ϵĺ�ɫ������û����Ԫ�أ�һ�����Ậ��������ͭ�����Դ��ǣ���F�����ʲ�����ɫ���ڼ�����У���ɫ������ΪCuCl��CuCl��������Ӧ�������Ȼ��⣬�����ɲ���ͨ����������Һ�У���D�������˰�ɫ������֤����ɫ����ΪCuCl��
���Դ��ǣ�D�г��ְ�ɫ��������װ��b�з�����ӦΪCuCl��������Ӧ����Ӧ�Ļ�ѧ����ʽΪ��2CuCl+H2 ![]() 2Cu+2HCl�����Դ��ǣ�2CuCl+H2
2Cu+2HCl�����Դ��ǣ�2CuCl+H2 ![]() 2Cu+2HCl��
2Cu+2HCl��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼa��b��c��d��Ϊ���缫����ѡ��ĵ������Һ���±���
�� | A | B | C | D |
�ײ� | NaOH | Cu��N O3��2 | KCl | Na2SO4 |
�Ҳ� | CuSO4 | NaCl | AgNO3 | NaNO3 |
Ҫ����������ǣ��ٹ���һ��ʱ��ײ۵��ҺpH���������Ҳ۵��ҺpH�½�����b��c�����ŵ����ӵ����ʵ�����ȣ���Ӧѡ�õĵ��Һ�ǣ� ��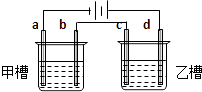
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴Ӧ��2A��g��+B��g��2C��g����H��0�����и�ͼ����ȷ���ǣ� ��
A.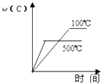
B.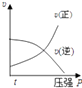
C.
D.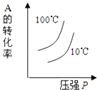
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100mL0.3mol/L��������Һ��50mL0.6mol/L��������Һ��ֻ�Ϻ���Һ��H+�����ʵ���Ũ��Ϊ
A. 0.6mol/L B. 0.8mol/L C. 0.3mol/L D. 0.4mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. ͬ��ͬѹ�£���ͬ��������ʣ������ʵ���һ�����
B. �κ��������������ʵ�����CH4��C0�����ķ�����һ�����
C. 1LCO����һ����1LO2������С
D. ��״���£�2.24LCCl4��6.02��1022������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ѣ�Ti������Ӳ�ȴ��۵�ߡ�����ʱ����ʴ�����㷺�������¿Ƽ����ϣ�����Ϊ��δ��������������������Ҫ�ɷ�FeTiO3 �� ����������Ϊ��Ҫԭ��ұ��������ͬʱ��ø���Ʒ�Ĺ�ҵ����������ͼ1�� 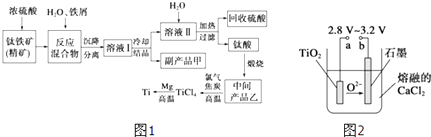
�ش��������⣺
��1���������Ũ���ᷴӦ�IJ���֮һ��TiOSO4 �� ��Ӧ�����������ɣ�����Ʒ���������� ��
��2���������������м�����м��Ŀ���� ��
��3����ʱ��Һ���к���Fe2+��TiO2+������Mg2+�������ӣ������£����Ӧ���������Ksp���±���ʾ��
�������� | Fe��OH��2 | TiO��OH��2 | Mg��OH��2 |
Ksp | 8.0��10��16 | 1.0��10��29 | 1.8��10��11 |
�ٳ����£���������Һ��Mg2+�����ʵ���Ũ��Ϊ0.0018molL��1 �� ����Һ��pH����ʱ��Mg��OH��2��ʼ������
����������Fe2+��TiO2+��Mg2+����Һ��ˮϡ�ͣ���������������ɫ������д���÷�Ӧ�����ӷ���ʽ��
��4��Mg��ԭTiCl4�����б�����1070K���¶��½��У�����Ϊ��Ӧ�ÿ��Ƶķ�Ӧ������ ��
��5����800��1000��ʱ���TiO2Ҳ���Ƶú����ѣ�װ����ͼ2��ʾ��ͼ��b�ǵ�Դ�����������ĵ缫��Ӧʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z�����ڱ��е�λ����ͼ��ʾ��������˵���д������
X | ||
Y | ||
Z |
A. X��Y��Z��X�ĵ������ȶ�B. Y���⻯��ΪHY
C. X������HXOD. �ܷ���Cl2+H2Z = Z+2HCl�ķ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС������ͼװ�õ��CuSO4��Һ���ⶨͭ�����ԭ�������� 
��1����ʵ���вⶨ�ڱ�״���·ų������������VL��B����ֱ����Դ�����������������������д��B��������Ӧ�ĵ缫��Ӧʽ ��
��2����ʼһ��ʱ�����U�ι��пɹ۲쵽������ ��
��д���õ�ⷴӦ�ܵ����ӷ���ʽ ��
��3��ʵ���л���ⶨ������������д��ţ���
��A������������mg ��B������������mg
��4��ͭ�����ԭ������Ϊ�����ú���m��V�ļ���ʽ��ʾ����
��5������ü��ԣ�KOHΪ����ʣ�����ȼ�ϵ����Ϊ��Դ����ʵ�飬�ŵ�ʱ�����ĵ缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com