
| A. | -1131.2 | B. | -647.6 | C. | -507.8 | D. | -323.8 |
分析 依据热化学方程式和盖斯定律计算得到所需热化学方程式,依据盖斯定律计算(②-③)×2+①×3,得到4NH3(g)+7O2(g)═4NO2(g)+6H2O(g)的△H.
解答 解:①2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
②N2(g)+2O2(g)═2NO2(g)△H=+67.8kJ•mol-1
③N2(g)+3H2(g)═2NH3(g)△H=-92.0kJ•mol-1
依据盖斯定律计算(②-③)×2+①×3,得到4NH3(g)+7O2(g)═4NO2(g)+6H2O(g)△H=-1131.2kJ•mol-1,
X的值是=-1131.2,
故选A.
点评 本题考查了热化学方程式的计算和盖斯定律的计算应用,理解实质,掌握基础是解题关键,题目较简单.


科目:高中化学 来源: 题型:解答题
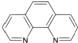 ),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.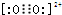 .已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.
.已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.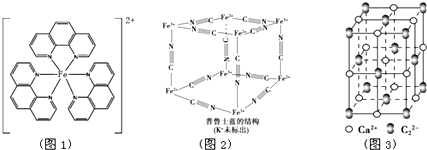
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液 | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+,若无明显变化,则说明不含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
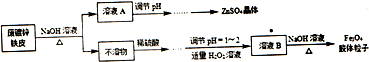
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲酸乙酯的结构简式:HCOOCH2CH3 | |
| B. | 质子数为53,中子数为75的碘原子:${\;}_{53}^{128}$I | |
| C. | 四氯化碳的电子式: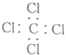 | |
| D. | 间甲基苯酚: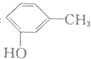 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①③⑤②④ | C. | ②⑤①③④ | D. | ②①③⑤④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com