
 ;氟离子和镁离子通过离子键形成离子化合物氟化镁,其形成过程为
;氟离子和镁离子通过离子键形成离子化合物氟化镁,其形成过程为 ,
, ;
; .
.


科目:高中化学 来源: 题型:
| A、①②③④⑤ |
| B、②③④①⑤ |
| C、③①②⑤④ |
| D、④⑤②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
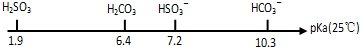
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ④ | ⑥ | ⑦ | |||||
| 3 | ① | ② | ③ | ⑤ | ⑧ | ⑨ | ⑩ | |
| 4 | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氘原子中的质子和中子 |
| B、C2H4分子中的质子和电子 |
| C、Na2O2固体中的阴离子和阳离子 |
| D、常温下,pH=7的CH3COOH与CH3COONa混合溶液中的H+与OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Co2O |
| 光照 |
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
| A、达到平衡时,需要从外界吸收的能量为0.968kJ |
| B、前20min内的平均反应速率v(H2O)=2.5×10-5mol?L-1?min-1 |
| C、增大c(H2O),可以提高水的分解速率 |
| D、使用颗粒更小的纳米级Cu2O,可以增大反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com