
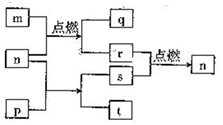
 ����������Ԫ��X��Y��Z��Wԭ��������������W2+�ĵ��Ӳ�ṹ������ͬ��m��W�ĵ��ʣ�r��X�ĵ��ʣ�s��Y�ĵ��ʣ�n��p��q����ЩԪ����ɵĶ�Ԫ�����t�����е�����Ԫ����ɣ���ˮ��Һ�ʼ��ԣ�p�ǵ���ɫ���壬q��һ�ּ�����������ǵĹ�ϵ��ͼ��ʾ��������
����������Ԫ��X��Y��Z��Wԭ��������������W2+�ĵ��Ӳ�ṹ������ͬ��m��W�ĵ��ʣ�r��X�ĵ��ʣ�s��Y�ĵ��ʣ�n��p��q����ЩԪ����ɵĶ�Ԫ�����t�����е�����Ԫ����ɣ���ˮ��Һ�ʼ��ԣ�p�ǵ���ɫ���壬q��һ�ּ�����������ǵĹ�ϵ��ͼ��ʾ��������| A�� | Y��Z��W�ļ����Ӱ뾶��W��Z��Y | B�� | ����������ˮ����ļ��ԣ�Z��W | ||
| C�� | ����̬�⻯������ȶ��ԣ�X��Y | D�� | Y��Z�γɵĻ������в����й��ۼ� |
���� ����������Ԫ��X��Y��Z��Wԭ��������������m��W�ĵ��ʣ�r��X�ĵ��ʣ�s��Y�ĵ��ʣ�n��p��q����ЩԪ����ɵĶ�Ԫ�����t�����е�����Ԫ����ɣ���ˮ��Һ�ʼ��ԣ�p�ǵ���ɫ���壬q��һ�ּ�����������ͼת����֪��pΪNa2O2��nΪCO2��tΪNa2CO3��sΪO2��mΪMg��qΪMgO��rΪC����Ԫ��XΪC��YΪO��ZΪNa��WΪMg��Ȼ����Ԫ�������������
��� �⣺A��Y��Z��W�ļ����ӵĵ��Ӳ�ṹ��ͬ����Ϊ10���ӽṹ���˵����Խ�����Ӱ뾶ԽС����ӦΪY��Z��W����A����
B��������Na��Mg��Ԫ�صĽ�����Խǿ����Ӧ������������ˮ����ļ���Խǿ����B��ȷ��
C���ǽ�����Y��O����X��C��������⻯����ȶ��ԣ�X��Y����C����
D��YΪO��ZΪNa���γɵĻ�������������к��й��ۼ�����D����
��ѡB��
���� ���⿼��������ƶϣ�Ϊ��Ƶ���㣬����ͼ��ת����Ӧ��pΪ��������Ϊ���Ĺؼ������ط������ƶ������Ŀ��飬ע��Ԫ�ػ�����֪ʶ��Ԫ�������ɵ�Ӧ�ã���Ŀ�ѶȲ���


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaClO | B�� | NH4Cl | C�� | CuSO4 | D�� | HNO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
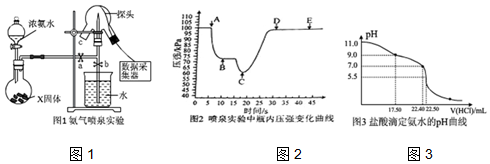
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ǿ����� | B�� | ������� | C�� | �ǵ���� | D�� | ���ӻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���ữѧʽ | HSCN | CH3COOH | HCN | H2CO3 |
| ����ƽ�ⳣ�� | 1.3��10-1 | 1.8��10-5 | 4.9��10-10 | K1=4.3��10-7K2=5.6��10-11 |
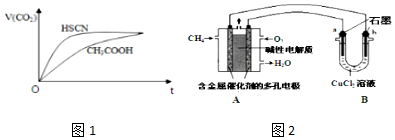
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
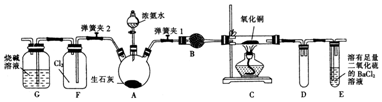
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 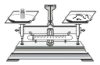 ��ȡ��Ʒ | B�� |  �ܽ���Ʒ | ||
| C�� | 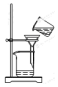 ����Al��OH��3���� | D�� |  ���������������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com