
| A. | 加入少量盐酸观察是否有气体产生 | |
| B. | 加热观察是否有气体产生 | |
| C. | 加入过量盐酸观察是否有气体产生 | |
| D. | 加入少量碳酸氢钙溶液观察是否有沉淀产生 |
分析 A.滴加少量盐酸,只发生酸碱中和反应生成水;
B.溶液中加热,纯碱不会分解;
C.加入过量盐酸,首先发生酸碱中和反应生成水,后盐酸与纯碱反应放出二氧化碳气体;
D.加入少量碳酸氢钙溶液,烧碱溶液与碳酸氢钙反应生成碳酸钙沉淀.
解答 解:A.滴加少量盐酸,只发生酸碱中和反应生成水,不能检验是否含纯碱,故A不选;
B.溶液中加热,纯碱不会分解,产生气泡可能为溶解的空气,不能检验是否含纯碱,故B不选;
C.加入过量盐酸,首先发生酸碱中和反应生成水,后盐酸与纯碱反应放出二氧化碳气体,所以加入过量盐酸观察是否有气体产生能检验是否含纯碱,故C选;
D.加入少量碳酸氢钙溶液,烧碱溶液与碳酸氢钙反应生成碳酸钙沉淀,不能检验是否含纯碱,故D不选;
故选C.
点评 本题考查物质的检验,为高频考点,把握物质的性质差异为解答的关键,注意选项A中试剂少量优先发生碱与酸,不能检验纯碱,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
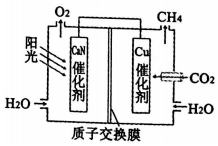
| A. | 该装置是原电池 | |
| B. | GaN催化剂表面发生氧化反应,溶液酸性增强 | |
| C. | 电子从GaN催化剂经导线转移到Cu催化剂 | |
| D. | Cu催化剂表面的反应是CO2+8H++8e-=CH4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 1 | 543 | 催化剂A | 12.3 | 42.3 |
| 2 | 543 | 催化剂B | 10.9 | 72.7 |
| 3 | 553 | 催化剂A | 15.3 | 39.1 |
| 4 | 553 | 催化剂B | 12.0 | 71.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH(l) | B. | CH3COOH(g) | C. | CO(g)+H2O(l) | D. | CO2(g)+H2O(l) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②④ | C. | ②③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | 有关性质及结构信息 |
| X | 所有已知晶体中硬度最大 |
| Y | Y原子的最高价氧化物和气态氢化物能化合成一种盐 |
| Z | 其氢氧化物溶于强碱溶液但不溶于水 |
| W | 其单质常存在于火山喷口处 |
| A. | Y、Z形成的简单离子半径大小关系是Y<Z | |
| B. | H-W键与H-Y键键能较大的是H-W键 | |
| C. | XW2可清洗附着在试管内壁的硫 | |
| D. | Z2W3不能与水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl- | |
| B. | NaHS溶液中:SO42-、K+、Cl-、Cu2+ | |
| C. | 通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- | |
| D. | $\frac{{K}_{W}}{c({H}^{+})}$=10-13mol•L-1的溶液中:NH4+、Mg2+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
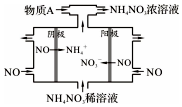 NO2是形成雾霾天气的原因之一.
NO2是形成雾霾天气的原因之一.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com