
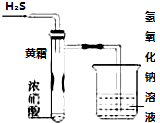
 某同学用下列实验装置探究硝酸的性质.根据图示判断下列结论不正确的是
某同学用下列实验装置探究硝酸的性质.根据图示判断下列结论不正确的是| A. | 试管内壁上“黄霜”的成分是硫 | |
| B. | 该实验探究说明浓硝酸既有氧化性,又有挥发性 | |
| C. | 烧杯内的NaOH溶液的作用是除去尾气,防止尾气污染环境 | |
| D. | H2S用SO2代替,将无明显反应现象 |
分析 A、硫化氢与浓硝酸发生氧化还原生成单质硫;
B、试管内壁上有黄霜生成说明硝酸有氧化性和挥发性;
C、硫化氢与硝酸发生氧化还原反应生成氮的氧化物,对环璄造成染污;
D、二氧化硫与浓硝酸发生氧化还原反应生成红棕的气体二氧化氮.
解答 解:A、硫化氢与浓硝酸发生氧化还原生成单质硫,所以试管内壁上“黄霜”的成分是硫,故A正确;
B、试管内壁上有黄霜生成说明硝酸有氧化性和挥发性,所以浓硝酸既有氧化性,又有挥发,故B正确;
C、硫化氢与硝酸发生氧化还原反应生成氮的氧化物,对环璄造成染污,所以烧杯内的NaOH溶液的作用是除去尾气,故C正确;
D、二氧化硫与浓硝酸发生氧化还原反应生成红棕的气体二氧化氮,而不是无明显现象,故D错误;
故选D.
点评 本题考查硝酸的化学性质,重点考查硝酸的强氧化性和挥发性,比较容易.


科目:高中化学 来源:2017届江苏省南通市如东县徐州市丰县高三10月联考化学卷(解析版) 题型:选择题
下列有关元素及其化合物的表示正确的是
A.CaH2的电子式:[H:]‑Ca2+[:H]-
B.Cl-的结构示意图:
C.质子数为92、中子数为146的U原子: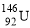
D.2,4,6-三硝基苯甲酸结构简式: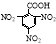
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学反应速率与化学平衡
化学反应速率与化学平衡| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 实验编号 | T(℃) | $\frac{n(CO)}{n({H}_{2})}$ | P(MPa) |
| i | 150 | $\frac{1}{3}$ | 0.1 |
| ii | 150 | $\frac{1}{3}$ | 5 |
| iii | 350 | $\frac{1}{3}$ | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属在潮湿的空气中腐蚀的实质是:M+nH2O═M(OH)n+$\frac{n}{2}$H2↑ | |
| B. | 金属的化学腐蚀的实质是:M-ne-═Mn+,电子直接转移给还原剂 | |
| C. | 金属的化学腐蚀必须在酸性条件下进行 | |
| D. | 在潮湿的中性环境中金属的电化学腐蚀主要是吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ${\;}_{2}^{3}$He核聚变是化学变化 | |
| B. | ${\;}_{2}^{3}$He和42He互为同素异形体 | |
| C. | ${\;}_{2}^{3}$He原子核内含仅含有1个中子 | |
| D. | ${\;}_{2}^{4}$He的最外层电子数为2,所以易失电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol•L-1CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)═0.1 mol•L-1 | |
| B. | 25℃时,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(C6H5ONa)>pH(NaHCO3)>pH(CH3COONa) | |
| C. | 25℃时,pH=9.4,浓度均为0.1 mol•L-1的HCN与NaCN的混合溶液中:c(Na+)>c(HCN)>c(CN-)>c(OH-) | |
| D. | 将足量AgCl分别放入:①5m水,②10mL0.2mol/LMgC12,③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
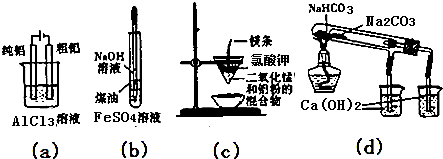
| A. | 用图(a)装置电解精炼铝 | |
| B. | 用图(b)装置制备Fe(OH)2 | |
| C. | 图(c)装置可制得金属钾 | |
| D. | 图(d)验证NaHCO3和Na2CO3的热稳定性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com