
| A. | 正丁烷分子储存的能量大于异丁烷分子 | |
| B. | 正丁烷的稳定性大于异丁烷 | |
| C. | 异丁烷转化为正丁烷的过程是一个放热过程 | |
| D. | 异丁烷分子中的碳氢键比正丁烷的多 |
分析 A.产物相同,能量高的放出的热量多;
B.能量越低越稳定;
C.正丁烷的能量大于异丁烷的能量;
D.正丁烷和异丁烷是同分异构体.
解答 解:A.根据能量守恒结合题意知,正丁烷的能量大于异丁烷的能量,故A错误;
B.正丁烷的能量大于异丁烷的能量,能量越大,物质越不稳定,所以正丁烷的稳定性小于异丁烷的稳定性,故B正确.
C.正丁烷的能量大于异丁烷的能量,再根据能量守恒得,异丁烷转化为正丁烷的过程是一个吸热过程,故C错误.
D.正丁烷和异丁烷是同分异构体,所以含有的氢原子数相同,即碳氢键相同,故D错误.
故选B.
点评 本题考查了能量转化的原因、分子的结构等知识点,难度不大,明确物质储存的能量与物质的稳定性的关系.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
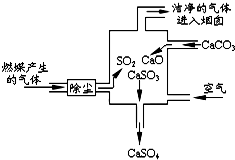
| A. | 此过程中没有分解反应 | |
| B. | 整个过程的反应可表示为:2SO2+2CaCO3+O2═2CaSO4+2CO2 | |
| C. | 使用此废气处理装置可减少CO2的排放 | |
| D. | 此过程中S元素的化合价未发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制的氯水在光照下颜色逐渐变浅 | |
| B. | H2、I2、HI平衡混合气缩小体积加压后颜色变深 | |
| C. | 工业上生产硫酸的过程中,SO2在催化氧化时条件控制为常压,而不是高压 | |
| D. | 工业上合成氨气时温度选择450℃左右,而不是常温 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:
碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H++2e→H2↑ | B. | 2H20+2C1-→H2↑+C12↑+20H- | ||
| C. | 2Cl--2e→Cl2↑ | D. | 2H20+2NaCl→H2↑+Cl2↑+2Na0H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能含有Fe2+和Fe3+ | B. | 可能含有Fe2+和Cu2+ | ||
| C. | 可能含有Cu2+和Fe3+ | D. | 可能含有单质铜和Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com