
【题目】重铬酸钠(Na2Cr2O72H2O)俗称红矾钠,在工业上有广泛的用途。我国目前主要是以铬铁矿(主要成份为FeOCr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
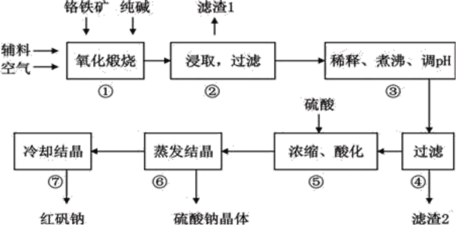
①中涉及的主要反应有:
主反应:4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
试回答下列问题:
(1)①中反应是在回转窑中进行,反应时需不断搅拌,其作用是__________________;
(2)③中调节pH至4.7,目的是__________________;
(3)⑤中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式:__________________;
(4)⑦中采用冷却结晶的方法析出红矾钠,依据是_________________________ ;
(5)制取红矾钠后的废水中还含有少量的CrO42-,根据有关标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于__________________mol·L-1,后续废水处理方能达到排放标准。
②还原法:CrO42-![]() Cr3+
Cr3+![]() Cr(OH)3。绿矾还原CrO42-的离子方程式为:__________________。用该方法处理10 m3CrO42-的物质的量浓度为1.5×10-3 mol·L-1的废水,至少需要绿矾(FeSO47H2O,相对分子质量为278)的质量是__________________kg(保留两位小数)。
Cr(OH)3。绿矾还原CrO42-的离子方程式为:__________________。用该方法处理10 m3CrO42-的物质的量浓度为1.5×10-3 mol·L-1的废水,至少需要绿矾(FeSO47H2O,相对分子质量为278)的质量是__________________kg(保留两位小数)。
【答案】使反应物接触更充分,加快反应速率 除去溶液中的AlO2-、SiO32- 2CrO42-+2H+![]() Cr2O72-+H2O 红矾钠的溶解度随温度的降低而减小 2.4×10-4 CrO42-+3Fe2++8H+=Cr3++3Fe3++4H2O 12.51
Cr2O72-+H2O 红矾钠的溶解度随温度的降低而减小 2.4×10-4 CrO42-+3Fe2++8H+=Cr3++3Fe3++4H2O 12.51
【解析】
以铬铁矿为原料制备重铬酸钠,铬铁矿经煅烧、水浸之后除去生成的氧化铁,调节pH至4.7,使溶液中的AlO2-、SiO32-转化为Al(OH)3、H2SiO3沉淀除去;然后将滤液经酸化、蒸发结晶后可生成重铬酸钠。
(1)①中反应是在回转窑中进行,反应时需不断搅拌,其作用是作用是使反应物接触更充分,达到加快反应速率的目的;
(2)③中调节pH至4.7,目的是使溶液中的AlO2-、SiO32-转化为Al(OH)3、H2SiO3沉淀除去;
(3)⑤中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,该反应的离子方程式为:2CrO42-+2H+![]() Cr2O72-+H2O;
Cr2O72-+H2O;
(4)⑦中采用冷却结晶的方法析出红矾钠,是由于红矾钠的溶解度随温度的降低而减小,降低温度,可以降低红矾钠的溶解度,从而结晶析出;
(5)①由于Ksp(BaCrO4)=1.2×10-10,Ksp(BaCrO4)=c(Ba2+)·c(CrO42-),含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放,所以此时溶液中c(Ba2+)=![]() mol/L=2.4×10-4 mol/L;
mol/L=2.4×10-4 mol/L;
②CrO42-、Fe2+在酸性条件下发生氧化还原反应,产生Cr3+、Fe3+及H2O,反应的离子方程式为:CrO42-+3Fe2++8H+=Cr3++3Fe3++4H2O,10 m3CrO42-的物质的量浓度为1.5×10-3 mol·L-1的废水中含有CrO42-的物质的量n(CrO42-)=1.5×10-3 mol·L-1×10 ×103 L=15 mol,则根据反应方程式可知需消耗绿矾的质量m(FeSO47H2O)=15 mol ×3×278 g/mol=12510 g=12.51 kg。


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】(1)将下列性质的编号,填入各小题后面对应的横线中:
A.脱水性;B.强酸性;C.氧化性;D.吸水性
①将胆矾放入装有浓H2SO4的干燥器中,过一段时间胆矾变白色。 ______
②在烧杯中放入蔗糖,滴入浓H2SO4变黑,并产生大量气体。 ______
③在冷浓HNO3中放入铝片没明显现象. ______
④用稀硫酸清洗金属表面的氧化物。 ______
(2)矿泉水一般是由岩石风化后被地下水溶解其中可溶部分生成的.此处所指的风化作用是指矿物与水和CO2同时作用的过程.例如钾长石(KAlSi3O8)风化生成高岭土[Al2Si2O5(OH)4],此反应的离子方程式为:2KAlSi3O8 +2 CO2 +7H2O = 2K+ + 2HCO3-+ 4H2SiO3 + Al2Si2O5(OH)4,这个反应能够发生的原因是 ______ 。
(3)为了验证木炭和浓H2SO4反应生成的CO2、SO2,选用下图所示仪器(内含物质)组装成实验装置:(每组只能选一次,不能重复选)
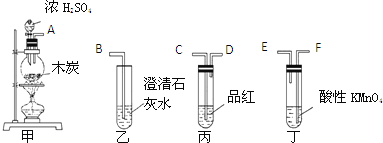
①如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):______ 接 ______ , ______ 接 ______ , ______ 接 ______ ;
②有怎样的实验现象才表明已检验出CO2? ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A. CCl4可由CH4制得,可萃取碘水中的碘
B. 乙烯和甲苯分子中所有原子都在同一个平面上
C. 煤油可由石油分馏获得,可用作燃料和保存少量金属钠
D. ![]() 和CH3-CH=CH2互为同分异构体
和CH3-CH=CH2互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池容易携带、容易存储等优点,目前被认为将会替代传统的电池成为携带型设备的主要电源。如图是甲醇的质子交换膜型燃料电池模型,下列有关说法正确的是( )
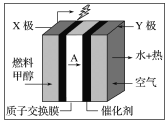
A.Y极为电池的负极
B.X极的电极反应式:CH3OH+H2O-6e-=CO2+6H+
C.若常温下用该电池电解100 mL KCl溶液至pH=12时,电池质子交换膜迁移的A为0.01 mol
D.空气以20%为氧气计算,X极每消耗1 mol甲醇,Y极必消耗168 L空气中的氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列物质转化中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸,当X无论是强酸还是强碱时,都有如下的转化关系:
![]()
当X是强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E都含另外同一种元素。请回答:
(1)A是__________,Y是__________,Z是__________。
(2)当X是强酸时,E是__________;B生成C的化学方程式是________________________。
(3)当X是强碱时,E是__________; B生成C的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 ph=5时沉淀完全).其中分析错误的是
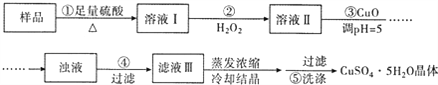
A. 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B. 步骤②可用氯水、硝酸等强氧化剂代替H2O2
C. 步骤③用 CuCO3代替CuO也可调节溶液的pH
D. 步骤⑤ 的操作为:向漏斗中加入少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作 2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和醋酸溶液,各加入生铁块,放置一段时间。下列有关描述不正确的是
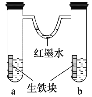
A.生铁块中的碳是原电池的正极
B.红墨水水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是Fe-2e- = Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯净物X、Y、Z转化关系如图所示,下列判断正确的是( )
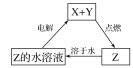
A. X可能是金属铜 B. Y不可能是氢气
C. Z可能是氯化钠 D. Z可能是三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
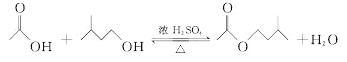
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
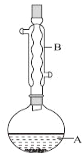
相对分子质量 | 密度(g·cm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.812 3 | 131 | 微溶 |
乙酸 | 60 | 1.049 2 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.867 0 | 142 | 难溶 |
实验步骤:
在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水![]() 固体,静置片刻,过滤除去
固体,静置片刻,过滤除去![]() 固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。
固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。
回答下列问题:
(1)仪器B的名称是_______________。
(2)在洗涤操作中,第一次水洗的主要目的是___________,第二次水洗的目的是______________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后_____________(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是。
(5)实验中加入少量无水![]() 的目的是_________________。
的目的是_________________。
(6)在蒸馏操作中,仪器选择及安装都正确的是__________(填标号)。
a. 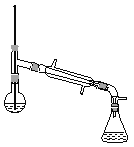 b.
b. 
c.  d.
d. 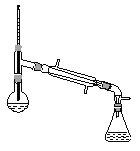
(7)本实验的产率是___________(填标号)。
a.30% b.40% c.60% d.90%
(8)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏___________(填“高”或“低”),其原因是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com