
| A. | 硫代硫酸钠溶液与稀硫酸反应:2S2O32-+4H+═3S↓+SO42-+2H2O | |
| B. | 在K2Cr2O7的溶液中:Cr2O72-+H2O?2 CrO42-+2H+ | |
| C. | 在KI的溶液滴加稀硫酸:4I-+4H++O2═I2+2H2O | |
| D. | 少量的铁与稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+2H2O |
分析 A.硫代硫酸钠与稀硫酸发生氧化还原反应,生成S、二氧化硫、水,产物错误;
B.橙红色的Cr2O72-在溶液中与黄色的CrO42-存在转化平衡;
C.在空气中,酸性条件下,碘离子被氧气氧化为碘单质,配平错误,原子不受;
D.Fe不足时,生成硝酸铁、NO和水.
解答 解:A.硫代硫酸钠与稀硫酸发生氧化还原反应,生成S、二氧化硫、水,该反应为Na2S2O3+H2SO4=S↓+SO2↑+H2O+Na2SO4,离子反应为S2O32-+2H+=S↓+SO2↑+H2O,故A错误;
B.在水溶液中,橙红色的Cr2O72-与黄色的CrO42-存在转化平衡:Cr2O72-+H2O?2CrO42-+2H+,故B正确;
C.在KI的溶液滴加稀硫酸,碘离子被氧气氧化为碘单质,反应的离子反应为4H++4I-+O2═2I2+2H2O,故C错误;
D.Fe不足时,生成硝酸铁、NO和水,反应为Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,离子反应为:Fe+4H++NO3-═Fe3++NO↑+2H2O,故D正确;
故选AC.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生反应及离子反应的书写方法为解答的关键,侧重氧化还原反应考查,注意硫代硫酸钠化学式的书写及S元素化合价,为易错点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 51.2% | B. | 36.8% | C. | 41.5% | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清的石灰水与稀盐酸反应Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 大理石溶于醋酸的反应CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| C. | 铜片插入硝酸银溶液中Cu+Ag+═Cu2++Ag | |
| D. | 钠与水的反应Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 | |
| B. | 杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 | |
| C. | H2SO4分子中三种原子均以杂化轨道成键 | |
| D. | N2分子中有一个σ键、2个π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将煤转化成气体燃料可以有效地减少“温室效应”的气体产生 | |
| B. | 加快太阳能、风能、生物质能、海洋能等清洁能源的开发利用 | |
| C. | 研制开发以水代替有机溶剂的化工涂料 | |
| D. | 大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
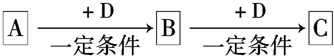
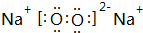 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
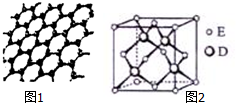 原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族且相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:
原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族且相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | 2F2+2H2O═4HF+O2 | D. | Na2O+2H2O═2NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com