
| A. | 冶炼金属时,必须加入一种物质作还原剂 | |
| B. | 利用金属活泼性的不同,可以采用不同的冶炼方法 | |
| C. | 湿法炼铜和火法炼铜的反应中,铜元素都发生还原反应 | |
| D. | 人类历史上大量生产和使用铝、铁、铜三种金属单质的时间顺序是铜、铁、铝 |
分析 A.选择金属冶炼的方法要依据金属在自然界中的存在形态和金属的活泼性;
B.不同的金属应选用不同的冶炼方法,金属的冶炼方法是根据金属的活动性强弱确定,即金属离子得电子的能力;
C.铜元素化合价由+2价变为0价,得电子的元素发生还原反应;
D.依据金属的化学性质和自然界中的存在形式,制取金属单质的难易程度和利用价值分析判断;根据常识判断:铜公元前20-30世纪,湿法冶炼铜;铁公元前10-11世纪;铝公元19世纪初发现公元19世纪末重晶石熔融电解法大规模生产.
解答 解:A.非常活泼的金属采用电解的方法冶炼,铝是活泼金属,所以采用电解法冶炼,所以不需加还原剂,故A错误;
B.根据金属的活动性强弱选择合适的冶炼方法,一般来说,活泼金属用电解法,如钠、铝等,较活泼金属用热还原法,如铜、铁等,不活泼金属如Hg、Ag等用热分解法冶炼,故B正确;
C.湿法炼铜和火法炼铜的反应中,铜元素化合价由+2价变为0价,所以Cu元素被还原,发生还原反应,故C正确;
D.活泼金属越强的金属自然界中易以化合态存在,且金属离子得电子能力较弱,生成和使用时间往往偏晚,铜、汞、银、金、锡、铅等金属都是最早使用的,它们的存在有的是游离态,有的熔点低容易冶炼,春秋晚期开始炼铁,战国时期开始炼钢,铝在自然界中制以化合态存在,且工业上是通过电解氧化铝得到,只是在近代才发明电后实现的,故生产和使用金属的顺序是铜、铁、铝,故D正确;
故选A.
点评 本题考查了金属的性质应用和金属冶炼的方法、时间,需要把常识性的知识积累才能解决问题,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 所有的蛋白质均可通过颜色反应来鉴别 | |
| B. | 淀粉和纤维素表达式为(C6H10O5)n,互为同分异构体 | |
| C. | 糖类、油脂、蛋白质均有C、H、O三种元素组成 | |
| D. | 油脂在碱性条件下水解生成甘油和高级脂肪酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
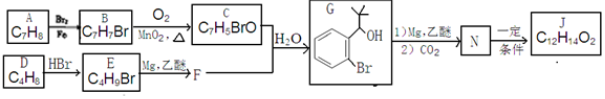

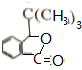 .
.
 反应①的反应条件和试剂分别为光照、Br2;L的结构简式为
反应①的反应条件和试剂分别为光照、Br2;L的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2在正极发生氧化反应 | |
| B. | 燃料电池的能量转化率可达100% | |
| C. | 工作一段时间后电解质溶液中OH-的物质的量浓度增大 | |
| D. | 产物为无污染的水,属于环境友好电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
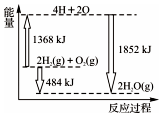
| A. | H2(g)和O2(g)反应生成H2O(g),这是个吸热过程 | |
| B. | 由2 mol H2和1 mol O2变成4 mol H、2 mol O原子,这是个放热过程 | |
| C. | 2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),共放出484 KJ能量 | |
| D. | 4 mol H、2 mol O生成2 mol H2O(g),共放出484 KJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH4$→_{光照}^{Cl_{2}}$HCl$\stackrel{NH_{3}}{→}$NH4Cl | |
| B. | CH2═CH2$→_{催化剂,△}^{H_{2}O}$CH3CH2OH$→_{催化剂,△}^{O_{2}}$CH3CHO | |
| C. | 淀粉$→_{△}^{催化剂}$葡萄糖$→_{△}^{AgNO_{3}溶液}$银镜 | |
| D. | NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{H_{2}O}{→}$HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,υ正(H2)=3υ逆(N2) | |
| B. | 保持容器压强不变时充入少量Ar气体,平衡不移动 | |
| C. | 升高温度,正向反应速率减小,逆向反应速率增加 | |
| D. | 该条件下,将1molN2和3molH2放在密闭容器中充分反应,放出92.4 kJ的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com