
| A、NH4HCO3溶液中加入少量稀NaOH溶液:NH4++OH-=NH3?H2O |
| B、FeBr2溶液中通入足量的氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| C、硫酸亚铁溶液中加入用硫酸酸化的双氧水Fe2++2H++H2O2=Fe3++2H2O |
| D、在通入过量SO2后的NaOH溶液中加足量的溴水(不考虑SO2的溶解):HSO3-+Br2+H2O=3H++2Br-+SO42- |


科目:高中化学 来源: 题型:
| c(Mg2+) |
| c(Cu2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑤ | B、①②⑤ | C、②④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
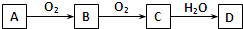
| A、A一定为单质 |
| B、C一定为氧化物 |
| C、D一定为酸 |
| D、A、B、C的相对分子质量之差为16或16的倍数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
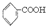 >H2CO3>
>H2CO3> >HCO3-将
>HCO3-将 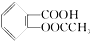 转变为
转变为 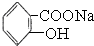 ,可行的方法是( )
,可行的方法是( )| A、向该溶液中加入足量的稀硫酸,加热 |
| B、将该物质与稀硫酸共热后,再加入足量的NaOH溶液 |
| C、将该物质与足量的NaOH溶液共热,再通入足量CO2气体 |
| D、将该物质与稀硫酸共热后,再加入足量的NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液中肯定不含I- |
| B、该溶液中可能含有Ba2+ |
| C、该溶液中肯定含有NH4+ |
| D、该溶液中可能含有MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大量使用的不是纯金属而是它们的合金 |
| B、目前已制得的纯金属只有90多种,但制得的合金已达几千种 |
| C、钢是最纯的铁 |
| D、废弃铝质包装既浪费金属材料又造成环境污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com