
某无色溶液中含有K+、Cl-、OH-、SO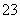 、SO
、SO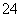 ,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法省略,检验其他阴离子的过程如下图所示。
,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法省略,检验其他阴离子的过程如下图所示。

(1)图中试剂①~⑤溶质的化学式分别是
①________,②________,③________,④__________,
⑤__________。
(2)图中现象a、b、c表明检验出的离子分别是
a________、b________、c________。
(3)白色沉淀A加试剂②反应的离子方程式是_________________________________
________________________________________________________________________。
(4)无色溶液C加试剂③的主要目的是_____________________________________。
(5)白色沉淀A若加试剂③而不加试剂②,对实验的影响是____________________。
(6)气体E通入试剂④发生反应的离子方程式是_______________________________
________________________________________________________________________。
答案 (1)Ba(NO3)2 HCl HNO3 Br2 AgNO3
(2)SO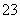 SO
SO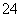 Cl-
Cl-
(3)BaSO3+2H+===Ba2++SO2↑+H2O
(4)中和OH-,防止对Cl-的检验产生干扰
(5)会使SO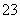 对SO
对SO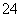 的检验产生干扰,不能确认SO
的检验产生干扰,不能确认SO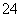 是否存在
是否存在
(6)SO2+Br2+2H2O===4H++SO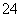 +2Br-
+2Br-
解析 该题的实 验目的是检验无色溶液中的阴离子:Cl-、OH-、SO
验目的是检验无色溶液中的阴离子:Cl-、OH-、SO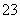 、SO
、SO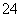 ,据框图分析,试剂①将其分为两组,而试剂②又将沉淀A部分溶解,其中沉淀B没被溶解,据此可判断沉淀A的成分为BaSO4和BaSO3,而气体E一定是SO2。据题中所给被选试剂,试剂①必定是Ba(NO3)2溶液,试剂②必是稀盐酸,试剂④必是溴水。溶液C中必含
,据框图分析,试剂①将其分为两组,而试剂②又将沉淀A部分溶解,其中沉淀B没被溶解,据此可判断沉淀A的成分为BaSO4和BaSO3,而气体E一定是SO2。据题中所给被选试剂,试剂①必定是Ba(NO3)2溶液,试剂②必是稀盐酸,试剂④必是溴水。溶液C中必含
Cl-、OH-、K+(原有)和Ba2+、NO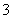 (新加入),向其中先加试剂③无沉淀又加入试剂⑤时出现白色沉淀,不难推出试剂③应为稀硝酸,目的是中和OH-,防止对下一步用试剂⑤AgNO3溶液检验Cl-产生干扰。
(新加入),向其中先加试剂③无沉淀又加入试剂⑤时出现白色沉淀,不难推出试剂③应为稀硝酸,目的是中和OH-,防止对下一步用试剂⑤AgNO3溶液检验Cl-产生干扰。


科目:高中化学 来源: 题型:
某兴趣小组同学在实验室用加热1-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如图所示装置,其中夹持仪器、加热仪器及冷却水管没有画出。
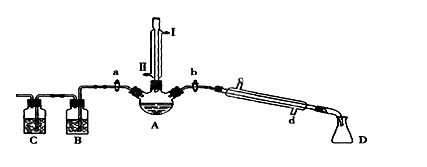
请根据实验步骤,回答下列问题:
(1)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。
竖直冷凝管接通冷凝水,进水口是_____(填“I”或“Ⅱ”);冷凝回流的主要目的是________。
(2)理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等。熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物。B、C中应盛放的试剂分别是_________和 ,写出C装置中主要的化学方程式:_______________。
(3)为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
请你补充下列实验步骤,直到分离出1-溴丁烷。
①待烧瓶冷却后,拔去竖直的冷凝管;
②_______;③_______;④_______;⑤_______,收集所得馏分。
(4)若实验中所取1-丁醇、NaBr分别为7.4 g、13.0 g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g1-溴丁烷,则1-溴丁烷的产率是_____。(保留2位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:
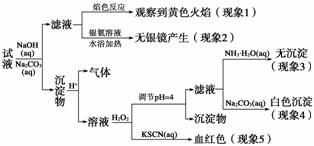
已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是 ( )
A.根据现象1可推出该试液中含有Na+
B.根据现象2可推出该试液中并不含有葡萄糖酸根
C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D.根据现象5可推出该试液中一定含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某溶液中可能含有SO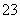 、SO
、SO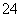 及其他某些未知离子,某同学取适量试液放入四支试管中,然后分别进行如下实验并得出相应的结论,其中合理的是 ( )
及其他某些未知离子,某同学取适量试液放入四支试管中,然后分别进行如下实验并得出相应的结论,其中合理的是 ( )
①若加入BaCl2溶液得到白色沉淀,然后加入足量的稀硝酸,沉淀不消失,说明原溶液中一定含有SO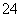
②若加入BaCl2溶液得到白色沉淀,然后加入足量的稀盐酸,沉淀溶解并产生刺激性气味的气体,说明原溶液中一定含有SO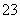
③若先加入盐酸无现象,再加入BaCl2溶液得到白色沉淀,说明原溶液中一定有SO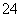
④若做焰色反应实验时,火焰呈黄色,说明溶液中一定有Na+,但不能确定是否有K+
A.①②③④ B.①④
C.②③④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是:
A.Cl2通往NaOH溶液中:Cl2+OH-=Cl-+ClO-+H2O
B.NaHCO3溶液中加入HC:CO32 -+2H+=CO2↑+H2O
C.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O AlO2- +4NH4+ +2H2O
AlO2- +4NH4+ +2H2O
D.Cu溶液于稀HNO3:3Cu+8H++2NO3- =3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
A是一种有机合成中间体,其结构简式为
A的合成路线如下图,其中B~H分别代表一种有机物。

请回答下列问题:
(1)A中碳原子的杂化轨道类型有 ① ;A的名称(系统命名)是 ② ;第⑧步反应的类型是 ③ 。
(2)第①步反应的化学方程式是
(3)C物质与CH2=C(CH3)COOH按物质的量之式1:1反应,其产物经加聚得到 可作隐形眼镜的镜片材料I。I的结构简式是
(4)第⑥步反应的化学方程式是
(5)写出含有六元环,且一氯代物只有两种(不考虑立体异构)的A的同分异构体的结构简式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3 、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6—2x]溶液,并用于烟气脱硫研究。
、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6—2x]溶液,并用于烟气脱硫研究。

(1)酸浸时反应的化学方程式为 ;滤渣Ⅰ的主要成分为 (填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6—2x。滤渣Ⅱ的主要成分为 (填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是  (用离子方程式表示)。
(用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是 ;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式错误的是
A.向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++ SO42 - =BaS04↓+2H2O
B.酸性介质中KMnO4氧化 H2O2:2MnO4- +5H2O2+6H+ = 2Mn2++5O2↑+ 8H2O
C.等物质的量的MgCl2、Ba(OH)2 和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓
D.铅酸蓄电池充电时的正极反应:PbSO4 + 2H2O-2e- = PbO2+4H++SO42 -
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com