
| A. | 工业上可利用空气冷冻成液体后再分离来获得液氧 | |
| B. | 煤油燃烧后的主要产物是水和二氧化碳,绿色环保 | |
| C. | 煤油属于纯净物.主要成分是烃 | |
| D. | 火箭装载的燃料越多,说明其动力越大 |
分析 A、氧气和氮气的沸点不同;
B、煤油是石油的分馏产物;
C、煤油仍然是多种烷烃和环烷烃的混合物;
D、火箭转载的燃料越多,则燃烧燃烧时放出的热量越多.
解答 解:A、氧气和氮气的沸点不同,故可以先将空气液化,然后再升高温度,使氮气先气化逸出,从而将氧气和氮气分离来获得液氧,故A正确;
B、煤油是石油的分馏产物,故煤油的主要成分碳氢化合物,故燃烧的主要产物为水和二氧化碳,无污染,故B正确;
C、煤油是石油的分馏产物,仍然是多种烷烃和环烷烃的混合物,不是纯净物,故C错误;
D、火箭转载的燃料越多,则燃烧燃烧时放出的热量越多,则说明火箭的动力越大,故D正确.
故选C.
点评 本题考查了石油的综合利用,难度不大,应注意的是石油是多种烷烃和环烷烃的混合物,其分馏产物仍然是混合物.


科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2+2H218O═4NaOH+18O2↑ | |
| B. | CH3COOH+CH3CH218OH→CH3COOCH2CH3+H218O | |
| C. | 5H218O2+2KMnO4+3H2SO4═518O2↑+K2SO4+2MnSO4+8H2O | |
| D. | K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
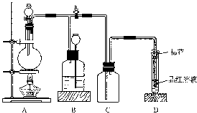 如图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置:
如图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 64 g SO2含有氧原子数为NA | |
| B. | 物质的量浓度为0.5mol/LAl2(SO4)3溶液,含有SO42-离子数为1.5NA | |
| C. | 标准状况下,22.4 LSO3的分子数为NA | |
| D. | 常温常压下,14 g N2含有分子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA | |
| B. | 常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA | |
| C. | 标准状况下,2.24L的CCl4中含有的C-Cl键数为0.4NA | |
| D. | 将CO2通过Na2O2使其增重a克时,反应中转移电子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com