


科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.空气 | B.二氧化碳 | C.氧气 | D.氦气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.没有沉淀物生成 |
| B.只有氢氧化铝沉淀生成 |
| C.只有氢氧化镁沉淀生成 |
| D.有氢氧化铝和氢氧化镁沉淀生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属钠投入Ca(HCO3)2溶液,反应后有白色沉淀析出 |
| B.干粉灭火器能用于扑灭金属钠、钾的着火 |
| C.生理盐水的质量分数为0.9%,与人体的血液中含量相同,它的溶质是NaCl |
| D.取用金属钠、钾时,所需实验用品有小刀、镊子、滤纸、玻璃片 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
|
查看答案和解析>>
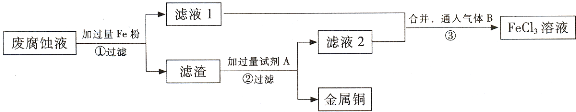
科目:高中化学 来源:不详 题型:实验题
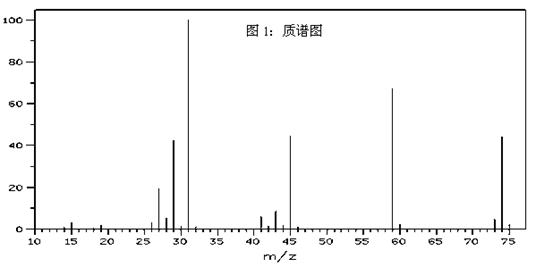
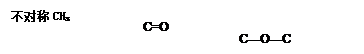
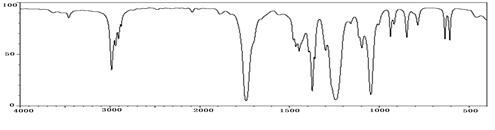
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com