海水是应用前景广阔的化工原料资源,从海水中可提取各种化工原料.如图是工业上对海水的几项综合利用的示意图:

回答下列问题:
(1)①粗盐中含有Ca
2+、Mg
2+、SO
42-等杂质,精制时所用试剂为:A:盐酸;B:BaCl
2溶液;C:NaOH溶液;D:Na
2CO
3溶液.加入试剂的顺序是
CBDA或BCDA
CBDA或BCDA
.
②电解饱和食盐水时,与电源正极相连的电极上发生的反应为
2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
,与电源负极线连的电极附近溶液pH
变大
变大
(变大、不变、变小).
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱.
①气体A、B是CO
2或NH
3,则气体A应是
NH3
NH3
(填化学式).C的制得发生反应的化学方程式为
.
②滤液D中主要含有NH
4Cl、NaHCO
3等物质,工业上是向滤液D中通入NH
3,并加入细小食盐颗粒,冷却析出不含有NaHCO
3的副产品
NH
4Cl晶体,则通入NH
3的作用是
氨气溶于水后生成氨水,氨水电离成铵根和氢氧根离子,增大铵根的浓度有利于氯化铵的析出来,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度;
氨气溶于水后生成氨水,氨水电离成铵根和氢氧根离子,增大铵根的浓度有利于氯化铵的析出来,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度;
.
(3)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.
a、写出步骤①④反应的离子方程式:①
2Br-+Cl2=2Cl-+Br2
2Br-+Cl2=2Cl-+Br2
;④
SO2+Br2+2H2O=2HBr+H2SO4
SO2+Br2+2H2O=2HBr+H2SO4
.
b、在步骤⑥的蒸馏过程中,温度应控制在80-90℃、温度过高过低都不利于生产,请解释原因:
温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低;
温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低;
.
c、在步骤①、②之后并未直接用“含溴的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO
2吸收”、“氯化”后再蒸馏,这样操作的意义是
“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能源少,成本降低.
“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能源少,成本降低.
.







 2Fe(s)+3CO(g) △H=-492.7kJ/mol
2Fe(s)+3CO(g) △H=-492.7kJ/mol 2Fe(s)+3CO2(g) △H=+25.2kJ/mol
2Fe(s)+3CO2(g) △H=+25.2kJ/mol 4Fe(s)+3CO2(g) △H=___________kJ/mol。
4Fe(s)+3CO2(g) △H=___________kJ/mol。
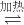 2Fe(s)+3CO(g)△H=-492.7kJ?mol-1
2Fe(s)+3CO(g)△H=-492.7kJ?mol-1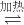 2Fe(s)+3CO2(g)△H=+25.2kJ?mol-1
2Fe(s)+3CO2(g)△H=+25.2kJ?mol-1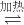 4Fe(s)+3CO2(g)△H=______kJ?mol-1
4Fe(s)+3CO2(g)△H=______kJ?mol-1