
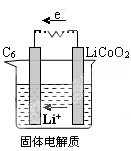
 铈、铬、钴、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.
铈、铬、钴、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.| 放电 |
| 充电 |

| c3(H+) |
| c(Fe3+) |
[
| ||
| c(Fe3+) |
| (Kw)3 |
| Ksp |
| c3(H+) |
| c(Fe3+) |
[
| ||
| c(Fe3+) |
| (Kw)3 |
| Ksp |
| (10-14)3 |
| 2.8×10-39 |


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
| A、A原子的最外层电子数比B原子的最外层电子数少 |
| B、A原子的电子层数比B原子的电子层数多 |
| C、1 mol A与足量酸反应生成的H2比1 mol B与足量酸反应生成的H2多 |
| D、常温时,A能从水中置换出氢,而B不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、至少存在5种离子 |
| B、Cl-一定存在,且c(Cl-)≥0.1mol/L |
| C、SO42-、NH4+一定存在,Cl-可能不存在 |
| D、CO32-、Al3+一定不存在,K+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
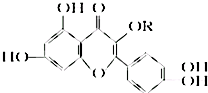 天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )| A、最多可以和含5 molBr2的溴水反应 |
| B、可用有机溶剂萃取 |
| C、分子中有三个苯环 |
| D、1 mol 维生素P可以和4 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
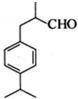 是一种重要的香料.用有机物I为原料可以合成兔耳草醛,其合成路线如图所示:
是一种重要的香料.用有机物I为原料可以合成兔耳草醛,其合成路线如图所示: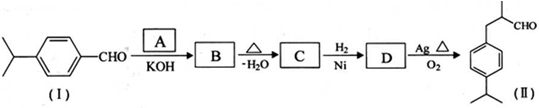
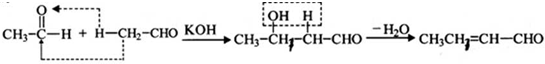
查看答案和解析>>
科目:高中化学 来源: 题型:
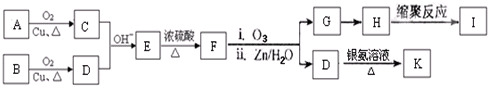
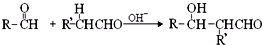 (-R、-R′表示氢原子或烃基)
(-R、-R′表示氢原子或烃基)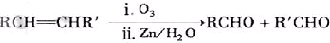
查看答案和解析>>
科目:高中化学 来源: 题型:
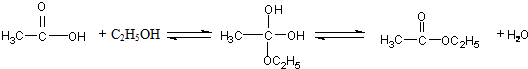
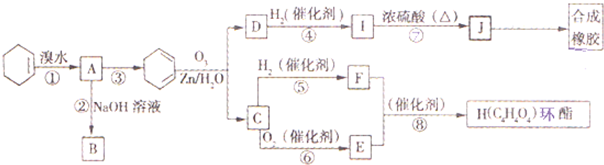 已知:( i)R1-CH=CH-R2
已知:( i)R1-CH=CH-R2| O3,Zn/H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
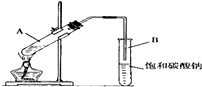 实验室用如图装置制取乙酸乙酯.
实验室用如图装置制取乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:
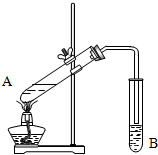 实验室用如图所示装置制取乙酸乙酯.
实验室用如图所示装置制取乙酸乙酯.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com