
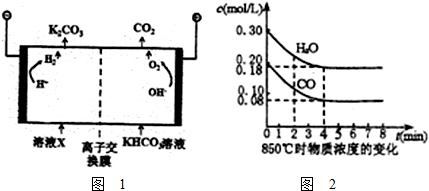
| 1 |
| 2 |
| 3 |
| 2 |
| 0.448L |
| 22.4L/mol |
| 0.448L |
| 22.4L/mol |
| 1 |
| 2 |
| 3 |
| 2 |
| 0.12mol/L |
| 4min |


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:

 ,写出由G生成I的化学反应方程式
,写出由G生成I的化学反应方程式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热能杀死H1N1流感病毒是因为病毒蛋白质受热变性 |
| B、不锈钢是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的 |
| C、明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
| D、加碘食盐中主要添加的是碘化钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 |
| B、MgCl2是强电解质,电解氯化镁溶液可以制得镁 |
| C、生石灰能与水反应,可用来干燥氯气 |
| D、硅酸钠的水溶液俗称水玻璃,可用作木材防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 时间/S | 0 | 500 |
| c(SO2)mol?L-l | 5.00 | 3.52 |
| 10 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2CO+O2
| ||||
| B、CaO+H2O=Ca(OH)2 | ||||
C、C+H2O
| ||||
| D、CO2+Ca(OH)2=CaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com