
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去)。

(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为 ;
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则
①C的化学式为 ;
②反应B+A→C的离子方程式为 ;
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)。
①若图b符合事实,则D的化学式为 ;
②若图c符合事实,则其pH变化的原因是 (用离子方程式表示);
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出A+D→C的热化学方程式 ;
(1)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(2)①Al(OH)3
②Al3++3AlO2-+6H2O=4Al(OH)3↓
(3)①CO2 ②2HSO3-+O2=2H++2SO42-
(4)C(s)+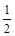 O2(g)=CO(g) ⊿H=-110.6kJ/mol
O2(g)=CO(g) ⊿H=-110.6kJ/mol
【解析】(1)A为金属单质,随D酸的稀溶液的量的不同而产物不同,故A是变价金属,故是Fe,D酸具有氧化性,稀溶液具有氧化性的酸是HNO3,故C+D→B反应为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(2)A、B为盐,A随强碱D溶液的量的不同而产物不同,A的水溶液显酸性,则是Al3+,C为Al(OH)3,B+A→C为Al3++3AlO2-+6H2O=4Al(OH)3↓;
(3)A为强碱,D为气态氧化物,D为二元酸酸酐,可以是CO2或SO2,b图是pH不变,为CO2;pH减小的是SO2,因为亚硫酸在空气中易氧化为硫酸使pH减小,即2HSO3-+O2=2H++2SO42-;
(4)A为非金属单质,空气主要成分D易反应是O2,能量关系看出反应计量:A+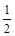 O2→C,C+
O2→C,C+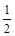 O2→B,A元素有+2、+4价,故A是碳,A+D→C的热化学方程式是C(s)+
O2→B,A元素有+2、+4价,故A是碳,A+D→C的热化学方程式是C(s)+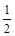 O2(g)=CO(g) ⊿H=-110.6kJ/mol。
O2(g)=CO(g) ⊿H=-110.6kJ/mol。


科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:计算题
以白云石(化学式表示为MgCO3·CaCO3)为原料制备Mg(OH)2的工艺流程如下图所示。

(1)研磨的作用是 。
(2)该工艺中可循环使用的物质是 、 (写化学式)。
(3)白云石轻烧的主要产物是MgO·CaCO3,而传统工艺是将白云石加热分解为MgO和CaO后提取,白云石轻烧的优点是 。
(4)加热反应的离子方程式为 。
(5)①加热反应时,在323k和353k溶液中c(NH4+)与反应时间的关系如下图所示,请在下图画出373k的曲线。

②由图可知,随着温度升高: 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测17 题型:选择题
Cu、Cu2O和CuO组成的混合物加入100 mL 0.6 mol/L HNO3溶液,恰好使混合物溶解,同时收集到224 mL NO气体(标准状况)。下列说法不正确的是
A.产物中硝酸铜的物质的量为0.025 mol
B.若混合物中Cu的物质的量为0.005 mol,则其中Cu2O、CuO的物质的量共0.020 mol
C.若混合物中含0.01 mol Cu,则其中Cu2O、CuO的物质的量均为0.005 mol
D.混合物中Cu的物质的量的取值范围为0.005 mol<n(Cu)<0.015 mol
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测16 题型:选择题
某温度时,在密闭容器中X、Y、Z三种气体浓度的变化如图甲所示,若其他条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图乙所示。则下列结论正确的是

A.该反应的热化学方程式为X(g)+3Y(g)  2Z(g) ΔH>0
2Z(g) ΔH>0
B.若其他条件不变,升高温度,正、逆反应速率均增大,X的转化率减小
C.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动
D.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测16 题型:选择题
下列热化学方程式书写正确的是(ΔH的绝对值均正确)
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1367.0 kJ·mol-1(燃烧热)
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1(中和热)
C.2NO2===O2+2NO ΔH=+116.2 kJ·mol-1(反应热)
D.S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1(反应热)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:推断题
弹性涤纶是一种新型聚酯纤维,具有优异性能,能作为工程塑料、纺织纤维和地毯等材料而得到广泛应用。其合成路线可设计为:

其中A、B、C均为链状化合物,A能发生银镜反应,C中不含甲基,1mol C可与足量钠反应生成22.4 L H2(标准状况)。请回答下列问题:
(1)A的结构简式为 ,B中所含官能团的名称为 。
(2)由物质C与D反应生成弹性涤纶的化学方程式为 。
(3)由物质B到C的化学反应类型为 。
(4)写出C与足量钠反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
实验:①向盛有1 mL 0.1 mol/L MgCl2溶液试管中加1 mL 0.2 mol/L NaOH溶液,得到浊液a,过滤得到滤液b和白色沉淀c。②向沉淀c中滴加0.1mol/LFeCl3溶液,沉淀变为红褐色。下列分析不正确的是
A、浊液a中存在沉淀溶解平衡:Mg (OH) 2(s) Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq)
B、滤液b中不含有Mg2+
C、②中颜色变化说明Mg (OH)2转化为Fe(OH)3
D、实验可以证明Fe(OH)3比Mg (OH)2更难溶
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测14 题型:推断题
碱式碳酸铜和氯气都是用途广泛的化工原料。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl?)制备碱式碳酸铜,其制备过程如下:

已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
开始沉淀pH | 4.2 | 5.8 | 1.2 |
完全沉淀pH | 6.7 | 8.3 | 3.2 |
①氯酸钠的作用是 ;
②反应A后调节溶液的pH范围应为 。
③第一次过滤得到的产品洗涤时,如何判断已经洗净? 。
④造成蓝绿色产品中混有CuO杂质的原因是 。
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。

①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏有 。
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因 。此时B装置中发生反应的离子方程式是 。
③写出A溶液中具有强氧化性微粒的化学式 。若向A溶液中加入NaHCO3粉末,会观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:填空题
锂的化合物用途广泛。Li3N是非常有前途的储氢材料;LiFePO4、Li2FeSiO4等可以作为电池的正级材料。回答下列问题:
(1)将锂在纯氮气中燃烧可制得Li3N,其反应的化学方程为 。
(2)氮化锂在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:
Li3N+2H2 LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。
LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。
(3)将Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃的氩气中烧结6小时制得Li2FeSiO4,写出反应的化学方程式 ,制备Li2FeSiO4的过程必须在惰性气体氛围中进行,其原因是 。
(4)将一定浓度磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出LiFePO4沉淀,阳极的电极反应式为 。
(5)磷酸亚铁锂电池充放电过程中,发生LiFePO4与Li FePO4之间的转化,电池放电时负极发生的反应为LiXC6-Xe—
FePO4之间的转化,电池放电时负极发生的反应为LiXC6-Xe— XLi++6C,写出电池放电时的电极反应的化学方程式 。
XLi++6C,写出电池放电时的电极反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com