
向含有10.26g金属M氢氧化物的澄清溶液中,加入NaHCO3和Na2CO3•xH2O固体混合物6.70g,充分反应后过滤,所得滤液为NaOH溶液,将其稀释至200mL,测得Na+的物质的量浓度为0.35mol/L;再将所得沉淀MCO3溶于足量的稀盐酸中,收集到气体2.64g。
请回答下列问题:
(1)通过计算确定M的元素符号。
(2)通过计算确定x的值。
【答案】40、(1)Ba (2)8
【解析】(1)根据生成的气体,可以求出M离子物质的量为2.64g/44g/mol = 0.06mol
10.26g/0.06mol = 171g/mol减去两个OH-,得到的就是137 所以M是钡,Ba
(2)滤液中,Na+的物质的量为0.35mol•L-1×0.2L = 0.07mol,因为滤液为氢氧化钠溶液,所以碳酸钠、碳酸氢钠都反应完全,而参与反应的碳酸根(也包括碳酸氢根)总物质的量为0.06mol,所以碳酸钠为0.01mol,碳酸氢钠为0.05mol
则有0.05×84 + 0.01×(106+18x) = 6.7,解得x = 8。


科目:高中化学 来源: 题型:
有a、b、c、d、e五种气体,现进行下列实验:
| (1)a和b混合 | 气体变红棕色 |
| (2)c和d混合 | 产生白烟 |
| (3)c和e分别通入少量溴水中 | 溴水都变成无色透明的液体 |
| (4)b和e分别通入氢硫酸中 | 都产生淡黄色浑浊 |
则a、b、c、d、e依次可能是( )
A.O2、NO、HCl、NH3、CO2
B.O2、NO、NH3、HCl、SO3
C.NO、O2、NH3、HCl、SO2
D.HCl、CO2、NH3、H2S、CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
现有容积相同的①和②两个密闭容器,向①中加入2molHI,向②中加入1molHI,在150℃时发生反应:2HI(g)  H2(g) +I2(g),一段时间后二者都达到了平衡状态,下列说法正确的是
H2(g) +I2(g),一段时间后二者都达到了平衡状态,下列说法正确的是
A.平衡时I2蒸气的浓度:①>②
B.平衡时I2蒸气在混合气体中的物质的量分数:①>②
C.平衡时HI的分解率:①=②
D.从反应开始到达平衡,所需时间:①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.炒过菜的铁锅不及时清洗易生锈
B.轮船吃水线以下的船壳外焊上锌块,可以防止铁船体被腐蚀
C.铁发生电化学腐蚀时铁为正极
D.经常用钢丝球擦洗铝锅表面,可以防止铝锅被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是
A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+===Fe3++3H2O
B.氯气溶于水:Cl2 + H2O = 2H+ + ClO- + Cl-
C.溴化亚铁溶液中通入足量氯气:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加少量Ba(OH)2溶液:
Al3++2SO +2Ba2++4OH-===AlO
+2Ba2++4OH-===AlO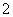 +2BaSO4↓+2H2O
+2BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在下列溶液中一定能大量共存的离子组是( )
A.酸性溶液:Na+、Fe2+、AlO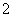 、SO
、SO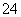
B.滴加石蕊试剂呈红色的溶液:Na+、Al3+、SO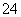 、Cl-
、Cl-
C.无色透明溶液:MnO4-、SO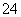 、K+、NO
、K+、NO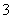
D.强碱性的溶液:CO 、NH
、NH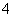 、Cl-、Ca2+
、Cl-、Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:
A(g)  B(g)+C(g) ΔH=+85.1 kJ·mol-1。
B(g)+C(g) ΔH=+85.1 kJ·mol-1。
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/ 100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为_______________________________________
________________________________________________________________________。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为____________,平衡时A的转化率为________ ,列式并计算反应的平衡常数K______________ ______。
______。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总=________mol,n(A)=________mol。
②下表为反应物A的浓度与反应时间的数据,计算:a=________。
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是
________________________________________________________________________,
由此规律推出反应在12 h时反应物的浓度c(A)为________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com