
| A. | 甲基的电子式: | B. | CH4分子的球棍模型: | ||
| C. | (CH3)2C=CH2的命名:1-甲基-2-丙烯 | D. | 甲醛的结构式: |
分析 A.甲基不带电荷,甲基中碳原子的外层有7个电子;
B.甲烷的球棍模型用小球和短棍表示,图示为甲烷的比例模型;
C.烯烃命名时,要选含官能团的最长碳链为主链,从离官能团近的一端开始编号;
D.结构式是利用短线“-”代替共用电子对,甲醛分子中碳原子与氢原子之间形成1对共用电子对,碳原子与氧原子之间形成2对共用电子对.
解答 解:A.甲基不带电荷,甲基中碳原子的外层有7个电子,甲基的电子式: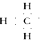 ,故A错误;
,故A错误;
B. 为甲烷的比例模型,甲烷的球棍模型为:
为甲烷的比例模型,甲烷的球棍模型为: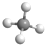 ,故B错误;
,故B错误;
C.烯烃命名时,要选含官能团的最长碳链为主链,从离官能团近的一端开始编号,故在2号碳原子上有一个甲基,故名称为:2-甲基-1-丙烯,故C错误;
D.甲醛分子中碳原子与氢原子之间形成1对共用电子对,碳原子与氧原子之间形成2对共用电子对,结构式为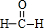 ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、比例模型、球棍模型、烯烃命名、结构式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的分析能力及规范答题能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某同学在实验室制取乙酸乙酯的主要步骤如下:
某同学在实验室制取乙酸乙酯的主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Ca2+、CI-、CO32- | B. | K+、Na+、OH-、CI- | ||
| C. | Na+、Mg2+、SO42-、OH- | D. | Cu2+、Ba2+、CI-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )| A. | X 为该电池的正极 | |
| B. | 若两电极分别为铜和锌,则X为铜,Y为锌 | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 若两电极都是金属,则X的还原性强于Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浅黄色沉淀可能是S | |
| B. | 溶液X中一定含有Fe3+ | |
| C. | 溶液X的溶质可能是FeBr2 | |
| D. | 如果浅黄色沉淀是AgI,则溶液X的溶质可能是FeI2或FeI3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com