
| Cu | Cu2O | CuO | Cu(OH)2 | CuSO4•5H2O |
| 红色(或紫红色) | 红色(或砖红色) | 黑色 | 蓝色 | 蓝色 |

分析 Ⅱ.(1)Cu2O与稀硝酸发生氧化还原反应生成硝酸铜、一氧化氮和水;
(2)①铜和氧化亚铜都能和硝酸生成Cu2+;
②氧化亚铜与稀硫酸反应生成Cu和Cu2+,金属铜和稀硫酸不反应;
(3)根据铜元素守恒计算得出正确结论;
Ⅲ.(4)根据大气压强原理来检验装置的气密性;
(5)根据水的存在会对实验结果造成影响来回答判断.
解答 解:Ⅱ.(1)Cu2O与稀硝酸发生氧化还原反应生成硝酸铜、一氧化氮和水,反应的化学方程式为:3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O,
故答案为:3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O;
(2)①铜和氧化亚铜都能和硝酸反应生成Cu2+,故方案1不合理,
故答案为:不合理,因为铜和氧化亚铜均可溶于稀硝酸形成蓝色溶液;
②氧化亚铜与稀硫酸反应生成Cu和Cu2+,金属铜和稀硫酸不反应,故方案2合理,
故答案为:合理,因为氧化亚铜与稀硫酸生成Cu和Cu2+,导致溶液呈蓝色;
(3)根据铜元素守恒,
则2Cu~Cu2O
128 144
b-a c-a
解得c=$\frac{9b-a}{8}$,故若红色粉末中含有Cu2O,则a、b与c的应符合的数学关系式为c<$\frac{9b-a}{8}$,
在空气中高温灼烧至质量恒定,这一步骤至少需称量2次,加上前面的2次称量,故该实验方案最少得进行4次称量,
故答案为:c<$\frac{9b-a}{8}$,4;
Ⅲ.(4)检验装置气密性的方法:关闭活塞,从长颈漏斗向试管中注入一定量的水,使漏斗内液面高于试管内液面,静置后若漏斗内液面不下降,则装置的气密性良好;液面下降,则装置漏气,
故答案为:关闭活塞,从长颈漏斗向试管中注入一定量的水,使漏斗内液面高于试管内液面,静置后若漏斗内液面不下降,则装置的气密性良好;液面下降,则装置漏气;
(5)根据硫酸铜是否变蓝判断是否含有氧化亚铜时,要注意水的干扰因素,所以制取的氢气要干燥,可以在氢气发生器与硬质玻璃管之间加一个干燥装置,并且要将空气中的水的干扰排除,可以在盛有硫酸铜的干燥管后再连接一个装有碱石灰的干燥管,实验前要将装置中的空气排净,防止干扰,
故答案为:ABC.
点评 本题是一道探究物质组成和实验方案设计的综合性试题,要求学生具有分析和解决问题的能力,难度较大.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
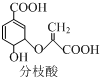 ,下列关于分枝酸的说法不正确的是( )
,下列关于分枝酸的说法不正确的是( )| A. | 分子中含有3种含氧官能团 | |
| B. | 1 mol分枝酸最多可与3mol NaOH发生中和反应 | |
| C. | 在一定条件下可与乙醇、乙酸反应,且反应类型相同 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,但褪色原理不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别加热,观察有无气体生成 | |
| B. | 制成稀溶液,再分别滴加同浓度的稀盐酸 | |
| C. | 制成稀溶液,分别加入CaCl2溶液 | |
| D. | 制成溶液,分别加入少量澄清的石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
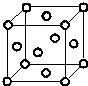 Q、R、X、Y、Z、W为周期表中原子序数依次递增的前四周期元素.
Q、R、X、Y、Z、W为周期表中原子序数依次递增的前四周期元素.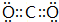 ,分子的空间构型是直线形;Z3+的原子结构示意图为
,分子的空间构型是直线形;Z3+的原子结构示意图为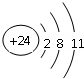 ;X2Q4分子中X原子的杂化方式为sp3杂化.
;X2Q4分子中X原子的杂化方式为sp3杂化.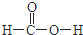 ,m g该物质完全燃烧后通过足量Na2O2固体充分吸收,Na2O2固体增重的质量为$\frac{15m}{23}$g
,m g该物质完全燃烧后通过足量Na2O2固体充分吸收,Na2O2固体增重的质量为$\frac{15m}{23}$g查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精的燃烧热△H=(Q2-Q3-3Q1)kJ/mol | |
| B. | 由③可知1molC2H5OH(g)的能量大于2molCO2(g)和3molH2O(g)的总能量 | |
| C. | H2O(g)→H2O(l)释放出了热量,所以该过程为放热反应 | |
| D. | 23g液态酒精完全燃烧生成CO2(g)和H2O(l),放出的热量为(0.5Q2-0.5Q3-1.5Q1)kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| B. | 25℃,在c(H+)=10-13mol/L的溶液中:NH4+、Al3+、SO42-、NO3- | |
| C. | 能使广泛pH试纸显蓝色的溶液中:Na+、K+、AlO2-、CO32- | |
| D. | 25℃,在pH=0的溶液中:K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径比较:X<Y<Z<W | |
| B. | Y的氢化物沸点高于W的氢化物 | |
| C. | Y的氢化物稳定性一定弱于W的氢化物 | |
| D. | 短周期所有元素中,w的最高价氧化物的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g D2O和18 g H2O中含有的质子数均为10NA | |
| B. | 标况下,22.4L单质溴所含有的原子数目为2NA | |
| C. | 2L 0.5 mol/L硫酸溶液中含有氢原子数目为2NA | |
| D. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a电极与电源的负极相连 | |
| B. | t2时,两电极的质量相差3.84 g | |
| C. | 电解过程中,溶液的pH不断增大 | |
| D. | t2时,b电极的电极反应是2H2O-4e-=2OH-+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com