
| ||
| ||
| ||
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | K=4.7×10-8 | K1=4.3×10-7,K2=5.6×10-11 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
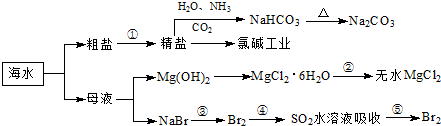
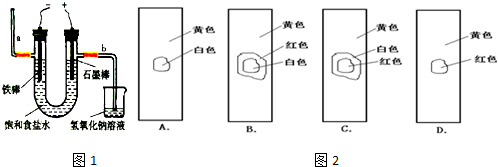
| ||
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省五校高三第一次联考化学试卷(解析版) 题型:填空题
工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。
(1)若采用无隔膜法电解冷的食盐水时,Cl2会与NaOH充分接触,导致产物仅是NaClO和H2。无隔膜法电解冷的食盐水相应的离子方程式为 。
(2)氯碱工业耗能高,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。

①经精制的饱和NaCl溶液应从图中电解池的 (填写“左” 或“右”)池注入。
②图中X是____ __(填化学式);乙中右室的电极反应式为: _ ,图示中氢氧化钠溶液质量分数a%与b%的关系是 (填字母)。
A. a%=b% B. a%﹥b% C. a%﹤b%
③甲中的离子交换膜为 (填“阳离子交换膜”或“阴离子交换膜”)。
(3)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol/L的4种钠盐溶液pH如下表:
|
溶质 |
Na2CO3 |
NaHCO3 |
NaClO |
NaHSO3 |
|
pH |
11.6 |
9.7 |
10.3 |
5.2 |
下列说法中,不正确的是 (填字母)
a.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
b.四种溶液中,水的电离程度最大的是NaClO
c.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
d.NaHSO3溶液中离子浓度大小顺序为c(Na+)> c(H+)>c(HSO3-) >c(SO32-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)氯碱工业中,通过电解饱和食盐水获得重要的化工原料:氯气、氢气和氢氧化钠。其中氯气用途十分广泛,除用于净水、环境消毒外,还用于生产盐酸、硅、聚氯乙烯、氯苯等。
(1)写出氯碱工业中通过电解饱和食盐水获得重要的化工原料氯气的离子方程式
(2)工业上可用氯气和石灰乳为原料制造漂白粉,写出该反应的化学方程式
(3)工业上生产半导体材料硅的流程如下:
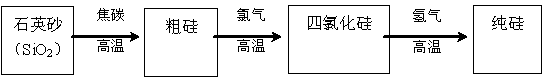
①写出在制备粗硅时反应的化学方程式_____________________________,在该反应的化学方程式上标出电子的转移方向和数目。此反应中焦炭的作用是____________。(填“氧化剂”或“还原剂”)
②粗硅与氯气反应后得到沸点较低的液态四氯化硅中常混有一些高沸点,难挥发性杂质,必须进行分离提纯。其提纯方法为____________。(填序号)
A.蒸馏 B.过滤 C.萃取 D.结晶
③由四氯化硅通入氢气得到高纯硅和氯化氢气体,写出该反应的化学方程式___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com