
| A、Cl->NH4+>H+>OH- |
| B、NH4+>Cl->H+>OH- |
| C、NH4+>Cl->OH->H+ |
| D、Cl->NH4+>OH->H+ |


科目:高中化学 来源: 题型:
| A、氯水漂白和活性炭漂白的原理相同 |
| B、酒精对伤口进行消毒和重金属离子中毒原理相同 |
| C、用合成洗涤剂清洗油污和用纯碱溶液清洗油污的原理相同 |
| D、明矾净水和臭氧净水的原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
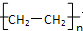 ,所发生的反应至少有:①取代反应 ②消去反应 ③酯化反应 ④聚合反应 ⑤还原反应 ⑥水解反应中的( )
,所发生的反应至少有:①取代反应 ②消去反应 ③酯化反应 ④聚合反应 ⑤还原反应 ⑥水解反应中的( )| A、①③ | B、②④ | C、②④⑤ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为: 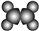 ③能与水在一定条件下反应生成醇 | ①由C、H两种元素组成; ②球棍模型为: 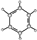 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、提高能源效率、寻找替代能源、保护森林以及生态友好型消费 |
| B、推广以液化石油气代替天然气作民用燃料 |
| C、推广利用二氧化碳与环氧丙烷和琥珀酸酐的三元共聚物的生物降解材料 |
| D、推广“绿色自由”计划,吸收空气中CO2并利用廉价能源合成汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液的浓度变为0.08mol/L |
| B、阳极上产生112mLO2(标准状况) |
| C、转移的电子数是1.204×1022个 |
| D、反应中有0.01mol的Ag被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ) 中形成的,以下电池的总反应方程式为:8Li+3SOCl2═6LiCl+LiSO3+2S,下列叙述中正确的是( )
) 中形成的,以下电池的总反应方程式为:8Li+3SOCl2═6LiCl+LiSO3+2S,下列叙述中正确的是( )| A、电解质溶液中混入水,对电池反应无影响 |
| B、金属锂作电池的负极,石墨作电池的正极 |
| C、电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO4 |
| D、电池工作过程中,金属锂提供电子的物质的量与析出硫的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com