
【题目】已知硼、氮、钴、铜是几种重要的元素,请回答下列向题:
(1)Co的基态原子中未成对电子数为________个;Cu的基态原子的电子排布式为_______。
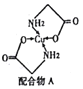
(2)Cu的配合物A的结构如右图,A中所含C、N、O三种元素的第一电离能由大到小的顺序为________。其中氮原子的杂化方式是_______________。
(3)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2 和N2, N2中δ键和π键数目之比是________;N2O与CO2互为等电子体,结构相似,且N2O分子中O只与一个N相连,则N2O的电子式为________。
(4)立方氮化硼的晶胞结构与金刚石结构相似(如下图),是超硬材料。
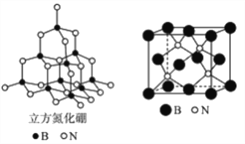
①晶胞中每个氮原子周围与其最近且等距离的硼原子有________个;
②结构化学上常用原子坐标参数表示晶胞内部各原子的相对位置,立方氮化翻的晶胞中,B原子的坐标参数分别有:B (0,0,0);B(![]() ,0,
,0, ![]() );B (
);B (![]() ,(
,(![]() ,
, ![]() ,0)等,则距离上述三个B原子最近且等距离的N原子的坐标参数为_________;
,0)等,则距离上述三个B原子最近且等距离的N原子的坐标参数为_________;
③已知氮化硼晶胞边长为apm,则氮化硼的密度为_______g·cm -3(设NA为阿伏加德罗常数值,只要求列算式)。
【答案】 3 1s22s22p63s23p63d104s1 或[Ar] 3d104s1 N>O>C sp3杂化 l : 2 ![]() 4 (l/4, l/4, l/4,)
4 (l/4, l/4, l/4,) ![]()
【解析】(1)Co的核电荷数为27,其价层电子排布式为3d74s2,其基态原子中未成对电子数为3个;Cu原子核外有29个电子,根据构造原理书写其基态原子核外电子排布式为1s22s22p63s23p63d104s1 或[Ar] 3d104s1 ;
(2)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以这三种元素第一电离能大小顺序是N>O>C;N原子价层电子对个数是4,根据价层电子对互斥理论判断N原子杂化方式为sp3;
(3)N2中σ键和π键数目之比为1:2,等电子体结构相似,根据二氧化碳电子式书写N2O的电子式为![]() ;
;
(4)①晶胞中每个氮原子周围与其最近且等距离的硼原子形成正四面体结构,硼原子数目为4;
②该晶胞中N原子个数是4、B原子个数=8×![]() +6×
+6×![]() =4,则B-N键个数为12,距离上述三个B原子最近且等距的N原子的坐标参数为(
=4,则B-N键个数为12,距离上述三个B原子最近且等距的N原子的坐标参数为(![]() 、
、![]() 、
、![]() );
);
③晶胞的体积为(a×10-10cm)3,晶胞的质量为![]() g,则氮化硼的密度为
g,则氮化硼的密度为![]() g÷(a×10-10cm)3=
g÷(a×10-10cm)3=![]() g·cm -3。
g·cm -3。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】全世界每年钢铁因锈蚀造成大量的损失。某城市拟用如图方法保护埋在酸性土壤中的钢质管道,使其免受腐蚀。关于此方法,下列说法不正确的是( )
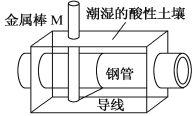
A.土壤中的钢铁易被腐蚀是因为在潮湿的土壤中形成了原电池
B.金属棒M的材料应该是比镁活泼的金属
C.金属棒M上发生反应:M-ne-=Mn+
D.这种方法称为牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有Cu2+、Fe2+、Mg2+、Cl-、NO3-,用石墨作电极进行电解时,肯定得不到的产物是
A. Cl2B. MgC. CuD. H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于合金的叙述中正确的是( )
A. 日常生活中用到的五角硬币属于铜合金
B. 低碳钢比中碳钢强度高
C. 合金在任何情况都比单一金属性能优良
D. 合金是由两种或多种金属熔合而成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见的某反应化学方程式为X +Y→M+N +H2O(未配平,反应条件已略去),下列叙述错误的是
A. 若X、Y的物质的量之比为1:4,且N是黄绿色气体,则该反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B. 若M、N为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪色,橙色褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-
C. 若X是铁,Y是稀硝酸(过量),则X与Y反应的离子方程式为Fe+4H++NO3- = Fe3+ +NO↑+2H2O
D. 当N为氯碱工业的主要原料,M是造成温室效应的主要气体,则上述反应的离子方程式一定为:CO32-+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究NH3的性质具有重要意义。请回答下列问题:
(1)已知:①NH3 (g)+3O2(g)=2N2(g)+6H2O(g) △H=-1266.5kJ·mol-1
②N2(g)+O2(g)=2NO(g) △H=+180.5 kJ·mol-1
写出氨高温催化氧化生成NO的热化学方程式___________。
(2)氨气、空气可以构成燃料电池,其电池反应原理为:4NH3+302=2N2+6H2O。已知电解质溶液为KOH溶液,则负极的电极反应式为________。
(3)合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的化学平衡常数K值和温度的关系如下:

由上表数据可知该反应的△H_______ 0 填“> ”、“< ”或“=”) ;
理论上,为了增大平衡时H2的转化率,可采取的措施是_______(选填字母);
A.增大压强 B.使用合适的催化剂 C.升高温度 D.及时分离出产物中的NH3
③400℃时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol·L-1、2 mol·L-1、l mol·L-1,此时刻该反应的V正(N2)=______ V逆(N2)。(填“>”、“<”或“=”)。
(4)已知25℃时,Ksp[Fe(OH)3]=1.0×l0-38, Ksp[Al(OH)3]=3.0×l0-34,当溶液中的金属离子浓度小于1.0×10-5mol·L-1时,可以认为沉淀完全。在含Fe3+、A13+的浓度均为1. 05mol·L-1的溶液中加入氨水,当Fe3+完全沉淀时,A13+沉淀的百分数____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和S![]() 可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是 ( )
可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是 ( )
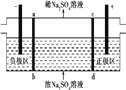
A. 通电后中间隔室的S![]() 离子向正极迁移,正极区溶液pH增大
离子向正极迁移,正极区溶液pH增大
B. 当电路中通过1 mol电子的电量时,会有0.5 mol的O2生成
C. 负极反应为2H2O-4e-![]() O2+4H+,负极区溶液pH降低
O2+4H+,负极区溶液pH降低
D. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】熟石灰在生产和生活中有广泛的用途。请回答:
(1)熟石灰中金属元素的原子结构示意图是_____。
(2)区分熟石灰溶液、氯化钠溶液、稀硫酸的操作及现象是__________。
(3)用石灰浆粉刷墙壁,干燥后墙面变硬,反应的化学方程式是_____。
(4)某地区土壤呈酸性(含硫酸),可选用熟石灰来改良,则反应的化学方程式是_________。
(5)用熟石灰粉与草木灰按一定比例混合可制得高效环保农药“黑白粉”。使用时,选择在有露 水的早晨,把“黑白粉”撒在植物茎叶上,可消除忌碱虫体。
①“黑白粉”比熟石灰更高效,是由于生成了碱性更强的物质,该反应的化学方程式是________。
②“黑白粉”中可提供植物生长和抗倒伏的营养元素是_____(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴下列有机实验操作或叙述,正确的是________________(填写代号)
A、用新制氢氧化铜悬浊液检验糖尿病患者现象是有黑色沉淀生成。
B、乙酸乙酯中少量乙酸可用饱和Na2CO3溶液除去
C、蔗糖水解时应用浓H2SO4作催化剂
D、在鸡蛋白溶液中滴入浓HNO3,加热会产生黄色物质
E、在植物油中滴入溴水,溴水褪色
F、用盐析法分离油脂皂化反应的产物
⑵实验室制乙烯:
①反应的方程式:_____________________________________
②浓H2SO4的作用:___________________________________
③发生装置中的温度计应插在:_________________________________
④实验中要使温度迅速升到170℃的原因是:__________________________
⑤反应时混合液逐渐变黑,是乙醇发生变化产生的气体有明显的刺激性气味,
所以,制备的乙烯中混有______________气体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com