
| 实验组别 | ① | ② | ③ | ④ |
| 硫酸溶液的体积(mL) | 50 | 50 | 50 | 50 |
| 盐的质量(g) | 9.260 | 13.890 | 20.835 | 32.410 |
| 二氧化硫的体积(mL) | 1344 | 2016 | 3024 | 2464 |
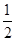 [n((NH4)2SO3)+n(SO2)]=
[n((NH4)2SO3)+n(SO2)]=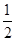 (0.14 mol+
(0.14 mol+ )="0.125" mol
)="0.125" mol 含NH4+的0.14 mol×3.5 =" 0.49" mol
含NH4+的0.14 mol×3.5 =" 0.49" mol


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.使某些有机色质褪色 | B.无色,有刺激性气味,无毒 |
| C.既有氧化性,又有还原性 | D.既可溶于水,又可与水反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
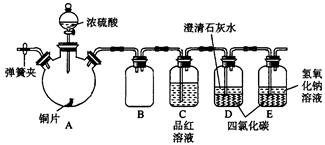
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Fe2O3+SO2↑+ SO3↑+ 14H2O,将生成的气体通入BaCl2溶液中,下列叙述中正确的是
Fe2O3+SO2↑+ SO3↑+ 14H2O,将生成的气体通入BaCl2溶液中,下列叙述中正确的是| A.有BaSO4生成 | B.有BaSO3生成 |
| C.同时有BaSO4和BaSO3生成 | D.有SO3逸出 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | | | |
| C | CuO固体 | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
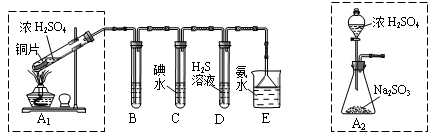
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 。 | 。 |
| 步骤3: 。 | 。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2能使FeCl3、KMnO4溶液褪色 | B.用澄清石灰水可鉴别CO2和SO2 |
| C.S在O2中燃烧可生成SO3 | D.SO2通入BaCl2溶液中能产生白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com