
| A. | 1:2 | B. | 2:1 | C. | 1:1 | D. | 无法比较 |
分析 同温同压下,气体的Vm相等,根据n=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$计算.
解答 解:同温同压下,气体的Vm相等,A容器中的氧气(O2)和B容器中的氨气(NH3)所含的原子个数相同,
由N=n×NA,可知2n(O2)=4n(NH3),
则n(O2):n(NH3)=2:1,
根据V=n×Vm可知,
V(O2):V(NH3)=2Vm:Vm=2:1,
故选B.
点评 本题考查阿伏加德罗定律及其推论以及物质的量的相关计算,题目难度不大,本题注意根据相关计算公式n=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$计算,注意同温同压下,气体的Vm相等.


科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F、G、H为八种相邻的短周期元素,其单质的沸点如图所示.
A、B、C、D、E、F、G、H为八种相邻的短周期元素,其单质的沸点如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②①③⑧⑦⑥⑤④ | B. | ②①③⑥⑦⑧⑤④ | C. | ①②③⑧⑦⑥④⑤ | D. | ②①⑧③⑦⑥④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | m=2 | |
| B. | 达平衡时,Z的体积分数为10% | |
| C. | 达平衡后,保持容器体积不变,加热,容器内压强将增大 | |
| D. | 将平衡后的容器体积压缩至1L,X的浓度为0.45mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
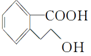 ,下列有关M的说法正确的是( )
,下列有关M的说法正确的是( )| A. | 该分子中存在一个手性碳原子 | |
| B. | M的分子式为C9H10O3 | |
| C. | 1 mol M能与足量Na反应生成0.5 mol H2 | |
| D. | 1 mol M完全燃烧消耗10 mol O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com