
根据废水中所含有害物质的不同,工业上有多种废水的处理方法。
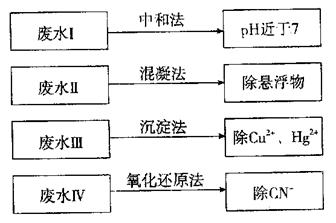
(1)①废水I若采用CO2处理,离子方程式是 。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO-3)越大,净水效果越好,这是因为 。
③废水III中的汞元素存在如下转化(在空格上填相应的化学式):
Hg2++ =====CH3Hg++H+
我国规定,Hg2+的排放标准不能超过0.05 mg/L。若某工厂排放的废水1 L中含 Hg2+3×10-17mo1,是否达到了排放标准 (填“是”或“否”)。
④废水Ⅳ常用C12氧化CN-成CO2和N2,若参加反应的C12与CN-的物质的量之比为5:2,则该反应的离子方程式为 。
(2)化学需氧量(COD)可量度水体受有机物污染的程度,它是指在一定条件下,用强氧化剂处理水样时所消耗的氧化刹的量,换算成氧的含量(以mg/L计)。某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
I.取V1mL水样于锥形瓶,加入10.00 mL 0.2500 mol/L K2Cr2O7溶液。
II.加碎瓷片少许,然后慢慢加入硫酸酸化,混合均匀,加热。
III.反应完毕后,冷却,加指示剂,用c mol/L的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定。终点时消耗硫酸亚铁铵溶液V2 mL。
①I中,量取K2Cr20,溶液的仪器是 。
②Ⅱ中,碎瓷片的作用是 。
③III中,发生的反应为:Cr2O2-7+6Fe2++14 H+==2Cr3++6Fe3+7H2O
由此可知,该水样的化学需氧量COD= (用含c、V1、V2的表达式表示)。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
 根据废水中所含有害物质的不同,工业上有多种废水的处理方法.
根据废水中所含有害物质的不同,工业上有多种废水的处理方法.| 8000×(15-cV2) |
| V1 |
| 8000×(15-cV2) |
| V1 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 8000×(15-cV2) |
| V1 |
| 8000×(15-cV2) |
| V1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)根据废水中所含有害物质的不同,工业上有多种废水的处理方法。
(1)废水I若采用CO2处理,离子方程式是 。
(2)废水II常用明矾处理。实验中发现废水中的c(HCO-3)越大,净水效果越好,这是因为 。
(3)废水III中的汞元素存在如下转化(在空格上填相应的化学式):
Hg2+ =====CH3Hg++H+
我国规定,Hg2+的排放标准不能超过0.05mg/L。某工厂排放的1m3废水中含Hg2+ 3×10-4mol,是否达到了排放标准 (填“是”或“否”)。
(4)废水IV常用Cl2将CN-氧化成两种无毒气体,则该反应的离子方程式为
.
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)
根据废水中所含有害物质的不同,工业上有多种废水的处理方法。
(1)①废水I若采用CO2处理,离子方程式是 。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO-3)越大,净水效果越好,这是因为 。
③废水III中的汞元素存在如下转化(在空格上填相应的化学式):
Hg2++ =====CH3Hg++H+
我国规定,Hg2+的排放标准不能超过0.05 mg/L。若某工厂排放的废水1 L中含 Hg2+3×10-17mo1,是否达到了排放标准 (填“是”或“否”)。
④废水Ⅳ常用C12氧化CN-成CO2和N2,若参加反应的C12与CN-的物质的量之比为5:2,则该反应的离子方程式为 。
(2)化学需氧量(COD)可量度水体受有机物污染的程度,它是指在一定条件下,用强氧化剂处理水样时所消耗的氧化刹的量,换算成氧的含量(以mg/L计)。某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
I.取V1mL水样于锥形瓶,加入10.00 mL 0.2500 mol/L K2Cr2O7溶液。
II.加碎瓷片少许,然后慢慢加入硫酸酸化,混合均匀,加热。
III.反应完毕后,冷却,加指示剂,用c mol/L的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定。终点时消耗硫酸亚铁铵溶液V2 mL。
①I中,量取K2Cr20,溶液的仪器是 。
②Ⅱ中,碎瓷片的作用是 。
③III中,发生的反应为:Cr2O2-7+6Fe2++14 H+==2Cr3++6Fe3+7H2O
由此可知,该水样的化学需氧量COD= (用含c、V1、V2的表达式表示)。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江西省高三下学期第一次模拟考试(理综)化学部分 题型:化学题
根据废水中所含有害物质的不同,工业上有多种废水的处理方法。

(1)①废水I若采用CO2处理,离子方程式是 。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO-3)越大,净水效果越好,这是因为
。
③废水III中的汞元素存在如下转化(在空格上填相应的化学式):
Hg2++ =====CH3Hg++H+我国规定,Hg2+的排放标准不能超过0.05 mg/L。若某工厂排放的废水1 L中含Hg2+3×10-17mo1,是否达到了排放标准 (填“是”或“否”)。
④废水Ⅳ常用C12氧化CN-成CO2和N2,若参加反应的C12与CN-的物质的量之比为5:2,则该反应的离子方程式为 。
(2)化学需氧量(COD)可量度水体受有机物污染的程度,它是指在一定条件下,用强氧化剂处理水样时所消耗的氧化刹的量,换算成氧的含量(以mg/L计)。某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
I.取V1mL水样于锥形瓶,加入10.00 mL 0.2500 mol/L K2Cr2O7溶液。
II.加碎瓷片少许,然后慢慢加入硫酸酸化,混合均匀,加热。
III.反应完毕后,冷却,加指示剂,用c mol/L的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定。终点时消耗硫酸亚铁铵溶液V2 mL。
①I中,量取K2Cr2O7,溶液的仪器是 。
②III中,发生的反应为:Cr2O72-+6Fe2++14 H+==2Cr3++6Fe3++7H2O
由此可知,该水样的化学需氧量COD= (用含c、V1、V2的表达式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com