
分析 同温同压下,气体摩尔体积相等,气体体积之比等于物质的量之比,同一化学反应中,不同气体物质的量之比等于计量数之比,所以三种气体的计量数之比为20mL:60mL:20mL=1:3:1,再根据原子守恒确定该化合物的化学式.
解答 解:同温同压下,气体摩尔体积相等,气体体积之比等于物质的量之比,同一化学反应中,不同气体物质的量之比等于计量数之比,所以三种气体的计量数之比为20mL:60mL:20mL=1:3:1,设生成物化学式为A,根据原子守恒得方程式为X2+3Y2=A,所以A的化学式为X2Y6,
故答案为:X2Y6.
点评 本题考查阿伏伽德罗定律及其推论,明确物质的量公式中各个物理量的关系是解本题关键,结合原子守恒解答即可,题目难度不大.


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:解答题
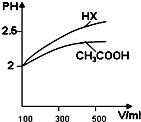 已知25℃时部分弱电解质的电离平衡常数数据如表:
已知25℃时部分弱电解质的电离平衡常数数据如表:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
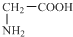

| A. | 全部 | B. | ①②④⑤⑥ | C. | ②③④⑤⑥ | D. | ②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
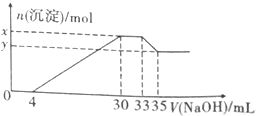 在100ml含Cu2+、Al3+、NH4+、H+、NO3-的溶液中,逐滴加入2.5mol•L-1NaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
在100ml含Cu2+、Al3+、NH4+、H+、NO3-的溶液中,逐滴加入2.5mol•L-1NaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )| A. | x-y=2×10-3mol | B. | 原溶液的pH=2 | ||
| C. | 原溶液中n(Cu2+)=0.025mol | D. | 原溶液中c(NH4+)=7.5×10-3mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 该溶液中含硝酸钾 202 g | |
| B. | 100 mL 该溶液中含硝酸钾 0.02 mol | |
| C. | 从 1 L 该溶液中取出 500 mL 后,剩余溶液的浓度为 0.1 mol/L | |
| D. | 1 L 水中溶解 0.2 mol 硝酸钾,即可配得 0.2 mol/L 硝酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴极呈无色,阳极呈红色 | B. | 正极呈红色,负极呈无色 | ||
| C. | 阳极呈无色,阴极呈红色 | D. | 负极呈红色,正极呈无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com