
关于下列各实验装置的叙述中,不正确的是()
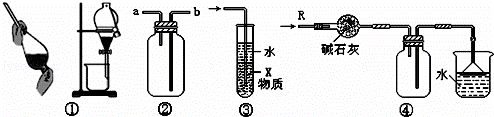
A. 装置①可用于分离C2H5OH和H2O的混合物
B. 装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C. 装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D. 装置④可用于干燥、收集NH3,并吸收多余的NH3
考点: 过滤、分离与注入溶液的仪器.
专题: 化学实验常用仪器.
分析: A、装置①为萃取、分液,可用于分离两种互不相容的两种液体;
B、装置②从a管进入气体,可收集密度比空气小的气体,从b管进入可收集密度比空气大的气体;
C、装置③可以吸收易溶于水的气体,并可防倒吸;
D、装置④可收集能用碱石灰干燥、密度比空气小且易溶于水的气体.
解答: 解:A、装置①萃取、分液,可用于分离两种互不相容的两种液体,而C2H5OH和H2O能以任意比互溶,不能装置①分离,可以用蒸馏的方法分离,故A错误;
B、装置②若从a管进入气体,可收集密度比空气小的气体,如氢气、氨气等;从b管进入可收集密度比空气大的气体,如二氧化碳、氯气、氯化氢、二氧化氮等,故B正确;
C、装置③X若为CCl4,NH3或HCl极易溶于水且不溶于CCl4的气体,可以用装置③并可防倒吸,故C正确;
D、氨气为碱性气体可用碱石灰干燥,氨气密度比空气小极易溶于水,可用向上排空气法收集,用一倒置的漏斗防倒吸并吸收多余的氨气,所以装置④可干燥、收集NH3,并吸收多余的NH3,故D正确.
故选A.
点评: 本题考查了常见的实验操作,完成此题,可以依据已有的知识进行,要求同学们加强对基础知识的储备,以便灵活应用.


科目:高中化学 来源: 题型:
在一支注射器中,装有NO2和N2O4(无色)的混合气体,它们的相互转化关系为:2NO2(g)⇌N2O4(g).在达到平衡状态后,如果慢慢压缩气体使体积变为原来的二分之一,此时混合气体的颜色与原来相比()
A. 由红棕色变为无色 B. 变浅
C. 由无色变为红棕色 D. 变深
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中氯离子浓度与50mL 1mol/L的AlCl3溶液中氯离子浓度相等的是()
A. 150mL 1mol/L的NaCl B. 75mL 2mol/L的NH4Cl
C. 150mL 3mol/L的KCl D. 75mL 2mol/L的CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法在一定条件下可以实现的是()
①酸性氧化物与碱反应
②弱酸与盐溶液反应可生成强酸
③没有水生成,也没有沉淀和气体生成的复分解反应
④两种酸溶液充分反应后的溶液呈中性
⑤有单质参加的非氧化还原反应
⑥两种含氧化合物反应的产物有气体.
A. ①②③④⑤⑥ B. ②④⑤⑥ C. ①②③⑤ D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学反应的离子方程式正确的是()
A. 氢氧化镁中滴加盐酸:H++OH﹣═H2O
B. 用FeCl3溶液腐蚀铜电路板:Fe3++Cu═Fe2++Cu2+
C. 在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7:H++SO42﹣+Ba2++OH﹣═BaSO4↓+H2O
D. NH4HCO3溶液中加入过量NaOH溶液并加热:NH4++HCO3﹣+2OH﹣ NH3Ÿ+CO32﹣+2H2O
NH3Ÿ+CO32﹣+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l、+2.已知Cu2O与稀硫酸反应,溶液呈蓝色.现向Cu、Cu2O和CuO组成的混合物中,加入1L 0.6mol/L HNO3溶液恰好使混合物溶解,同时收集到2240mL NO气体(标准状况).请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的离子方程式
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 .
(3)若混合物中含0.1mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 .
(4)若混合物中Cu的物质的量为n mol,则n的取值范围为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表是一座开放的“元素大厦”,40号元素在元素周期表中的位置是()
A. 第四周期第ⅡA族 B. 第五周期第ⅣB族
C. 第五周期第IVA族 D. 第五周期第ⅡA族
查看答案和解析>>
科目:高中化学 来源: 题型:
铅蓄电池是工作时的电池反应为:PbO2+2H2SO4⇌2PbSO4+2H2O;试回答:
(3)铅蓄电池正极的电极材料是 .
(4)工作时该铅蓄电池负极的电极反应是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
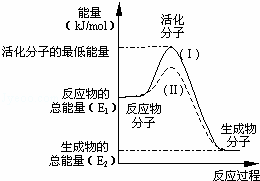
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应.能引发化学反应的碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ•mol﹣1表示.请认真观察下图,然后回答问题.
(1)图中反应是 (填“吸热”或“放热”)反应,该反应 (填“需要”或“不需要”)提供能量,该反应的△H= (用含E1、E2的代数式表示).
(2)已知热化学方程式:H2(g)+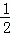 O2(g)═H2O(g)△H=﹣241.8kJ•mol﹣1,该反应的活化能为167.2kJ•mol﹣1,则其逆反应的活化能为 .
O2(g)═H2O(g)△H=﹣241.8kJ•mol﹣1,该反应的活化能为167.2kJ•mol﹣1,则其逆反应的活化能为 .
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com