
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是( )
A.原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.Y分别与Z、W形成的化合物中化学键类型相同
C.X的最高价氧化物对应的水化物的酸性比W的弱
D.Y的气态简单氢化物的热稳定性比W的强
科目:高中化学 来源: 题型:
世博会中国馆、主题馆等建筑所使用的光伏电池,总功率达4兆瓦,是历届世博会之最。下列有关叙述正确的是( )
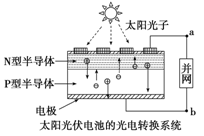
A.光伏电池是将太阳能转变为电能
B.光伏电池是将化学能转变为电能
C.电流从a流向b
D.图中N型半导体为正极,P型半导体为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
根据第ⅡA族、第ⅦA族元素性质的递变规律,回答下列问题:
(1)Be(OH)2的溶解性:________溶于水,属于________性氢氧化物。
(2)砹(At)属于________色固体,HAt________稳定,水溶液呈________性,其酸性________(填“大于”或“小于”)HBr的酸性;AgAt________溶于水。
查看答案和解析>>
科目:高中化学 来源: 题型:
比较下列微粒半径大小,用“>”或“<”填空
(1)Na________Mg________Cl。
(2)Li________Na________K。
(3)Na+________Mg2+________Al3+。
(4)F-________Cl-________Br-。
(5)Cl-________O2-________Na+________Mg2+。
(6)Fe2+________Fe3+。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、W四种短周期元素在周期表中的相对位置如下所示,下列说法正确的是( )
| X | Y |
| Z | W |
A.非金属性:X<Y<Z
B.W的原子序数可能是Y的原子序数的2倍
C.气态氢化物稳定性:Y<W
D.Z一定比X活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米、淀粉等发酵制得。A的钙盐是人们喜爱的补钙剂之一,A在某种催化剂存在下进行氧化,其产物不能发生银镜反应。在浓硫酸存在下,A可发生如下反应。
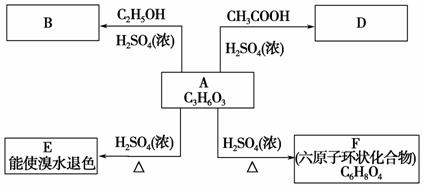
试写出:
(1)化合物A、B、D的结构简式:
A________;B________;D________。
(2)化学方程式:
A→E_________________________________________________________;
A→F__________________________________________________________。
(3)反应类型:A→E________;A→F________。
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2是一种大气污染物,某兴趣小组欲探究SO2的性质及绿色实验方法,设计如下方案:
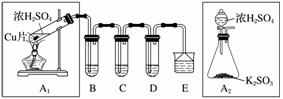
(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性。其中C、D分别为碘水和硫化氢的水溶液,则B中所盛试剂为__________,C中反应的离子方程式为________________________________________________________________________。
(2)为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是________________________________________________________________________
(任写一点即可)。
(3)E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO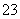 、SO
、SO 、HSO
、HSO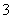 等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol·L-1盐酸、2 mol·L-1 HNO3、1 mol·L-1 BaCl2溶液、1 mol·L-1 Ba(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO
等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol·L-1盐酸、2 mol·L-1 HNO3、1 mol·L-1 BaCl2溶液、1 mol·L-1 Ba(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO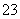 和HSO
和HSO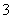 ,完成下表的实验操作、预期现象和结论:
,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1 mol·L-1 BaCl2溶液滴入小烧杯中直至过量 | 若出现白色浑浊,则溶液中存在SO |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体______________ | |
| 步骤3: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com