
【题目】工业上通过反应“SiO2+2C![]() Si+2CO↑”制取单质硅,下列说法正确的是( )
Si+2CO↑”制取单质硅,下列说法正确的是( )
A. 自然界中硅元素均以SiO2形式存在
B. 硅的化学性质不活泼,常温下不与任何物质反应
C. 该反应条件下C的还原性比Si强
D. 生成4.48 L CO时转移电子数为0.4×6.03×1023
科目:高中化学 来源: 题型:
【题目】我国在春秋战国时期,就懂得将白铁褪火处理得到相当于铸钢的物器(如锋利的宝剑),这一技术要比欧洲早就两千年,那么白铁褪火处理的主要作用是
A、除去硫、磷杂质 B、适当降低了含碳量
C、渗入了合金元素 D、改善表面的结构性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地壳中铝元素比铜元素含量高很多,但人们冶炼出铜比铝早很多年。合理的解释是( )
A. 铜矿较易还原,铝矿很难还原
B. 铜矿颜色较深,易发现;铝矿颜色较浅,不易发现
C. 矿石在地下埋藏,铜矿最浅,容易开发,铝矿埋得深,难开发
D. 铜比铝的相对原子质量大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)硅在元素周期表中的位置是_______。
(2)工业生产粗硅的反应有:SiO2+2C![]() Si(粗)+2CO↑,SiO2+3C
Si(粗)+2CO↑,SiO2+3C![]() SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。
SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。
(3)工业上可以通过如下图所示的流程制取纯硅:
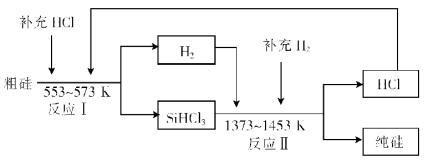
①若反应I为 Si(粗)+3HCl![]() SiHCl3+H2,
SiHCl3+H2,
则反应II的化学方程式为 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另 一种物质,写出该反应的化学方程式: 。
③假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应mA(g)+nB(g)pC(g)+qD(g)的平衡常数为K,下列说法正确的是( )
A.K越大,达到平衡时,反应物的转化率越大B.K越小,达到平衡时,反应物的转化率越大
C.K随反应物浓度改变而改变D.K随温度的改变而改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com