
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法正确的是

A.右侧发生的电极方程式:O2+4e-+2H2O=4OH-
B.电解槽内发生反应的总化学方程式是KI+3H2O=KIO3+3H2↑
C.电解结束后,右侧溶液中不可能含有IO3-
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内反应的总化学方程式不变
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
加碘食盐中含有的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:

(1)步骤②中氢氧化钾的主要作用是 ▲ 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,可经过 ▲ 、过滤、洗涤、干燥等步骤。
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3/100g水 | 8.08 | 12.6 | 18.3 | 24.8 |
(3)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-
为了测定加碘食盐中碘的含量,某学生设计了如下实验:准确称取wg食盐,加适量蒸馏水使其完全溶解;再用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;最后加入指示剂,以物质的量浓度为2.00×10-3mol·L-1的Na2S2O3溶液滴定,消耗10.00mL时恰好反应完全。
① 在滴定过程中,所用的玻璃仪器为 ▲ 、 ▲ 。
② 该实验可以用 ▲ 作指示剂,滴定终点的现象是 ▲ 。
③ 下列有关该滴定实验的说法不正确的是 ▲ 。
A.滴定管在使用前必须检查是否漏水并润洗
B.滴定时眼睛注视滴定管内溶液液面变化
C.为减小实验误差,可用少量的蒸馏水冲洗锥形瓶内壁
D.终点读数时俯视会导致碘的含量偏低
④加碘食盐样品中的碘元素含量是 ▲ g·kg-1(以含w的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
选择序号填空:
①16O和18O ②金刚石和石墨 ③CH3CH3和CH3CH2CH2CH3 ④CH3CH2CH2CH3 和CH3CH (CH3) CH3
(1)属于同素异形体的是 ; (2)互为同位素的是 ;
(3)互为同分异构体的是 ; (4)属于同系物的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年4月24日,东航首次成功进行了由地沟油生产的生物航空燃油的验证飞行。能区别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是
A.点燃,能燃烧的是矿物油
B.测定沸点,有固定沸点的是矿物油
C.加入水中,浮在水面上的是地沟油
D.加入足量氢氧化钠溶液共热,不分层的是地沟油
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学──选修2:化学与技术] (15分)
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
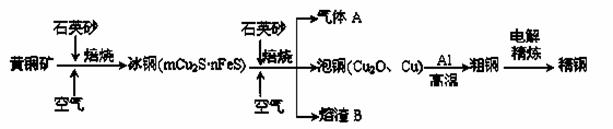
(1)气体A中的大气污染物可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2) ①冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是 、______________________________;
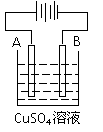 ②熔渣B的主要成分是_______________。
②熔渣B的主要成分是_______________。
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)粗铜(含Fe、Ag、Pt、Au等杂质) 的电解精炼如图所示,A极上
发生的反应为__________________________________________,
下列说法正确的是 。
a.电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动 d.阴阳两极质量变化相等
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,
其正极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质相互混合反应,既有气体生成最终又有沉淀生成的是
①金属钠投入FeCl3溶液中 ②过量的NaOH溶液和明矾溶液
③Na2S2O3溶液与稀硫酸 ④ Na2O2投入FeCl2溶液中
⑤浓硫酸铵溶液加入到浓氢氧化钠中 ⑥Al2(SO4)3与Na2SiO3溶液
A.①②④ B.③④⑤ C.①③④⑥ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:


(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3 + 3S 2Al2O3 + 9SO2,该反应的氧化剂是_______,若生成1 mol Al2O3,则转移的电子数为_______。
(2)将标况下1.12L炉气通入100mL 0.5mol/L NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为_______________________________________。
(3)熟料溶解时反应的离子方程式为 。
(4)检验废渣中含有Fe2O3所需的试剂是_________。
(5)母液中溶质主要成分化学式为 ,溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上消除氮氧化物的污染,可用如下反应:
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol
在温度T1和T2时,分别将0.50 molCH4和1.2 molNO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4) | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法不正确的是
A.10 min内,T1时υ(CH4)比T2时小 B.温度:T1<T2
C.ΔH:a<0 D.平衡常数:K(T1) <K(T2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com