
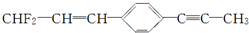
 的下列叙述中,正确的是( )
的下列叙述中,正确的是( )| A. | 该有机物物质的类别为:卤代烃、烯烃、炔烃 | |
| B. | 该有机物分子式:C12H9F2 | |
| C. | 最多有8个碳原子在同一直线上 | |
| D. | 12个碳原子有可能都在同一平面上 |
分析 该有机物的命名遵循官能团优先规则,共线共面问题可根据常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行共线、共面分析判断,注意单键可以旋转.
解答 解:A.有机物官能团命名优先顺序为-COOH>-SO3H>-SO3NH2>-COOCO->-COOR>-COX>-CONH>-CN>-CHO>-CO->-OH>-NH2>-O->-S->>C=C<>-C≡C->-R>-X>-NO2,故该有机物将F原子作为取代基,烯烃为母体命名,故A错误;
B.根据结构式确定有机物的分子式为:C12H10F2,故B错误;
C.双键相连的碳与CF2的碳不在同一直线上,与苯环C直接相连的C、苯环上的2个C、三键相连的C可以在同一直线上,共最多6个C共直线,故C错误;
D. 为分子中,CF2中C原子处于苯中H原子的位置,苯环平面与碳碳双键形成的平面通过旋转碳碳单键可以处于同一平面,乙炔是直线型结构,所以最多有12个C原子共面,故D正确.
为分子中,CF2中C原子处于苯中H原子的位置,苯环平面与碳碳双键形成的平面通过旋转碳碳单键可以处于同一平面,乙炔是直线型结构,所以最多有12个C原子共面,故D正确.
故选D.
点评 本题考查有机物结构中共面、共线、分子式确定、命名等问题,难度中等,关键是空间想象,做题时注意从甲烷、乙烯、苯和乙炔的结构特点判断有机分子的空间结构,单键可以旋转.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
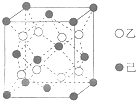 乙、丙、丁简单离子的核外电子排布相同,这三种元素按6:3:1的原子个数比可形成一种离子晶体W;丙与戊可形成常见离子晶体X,甲与己可形成常见离子晶体Y,且X和Y电子数相同.
乙、丙、丁简单离子的核外电子排布相同,这三种元素按6:3:1的原子个数比可形成一种离子晶体W;丙与戊可形成常见离子晶体X,甲与己可形成常见离子晶体Y,且X和Y电子数相同.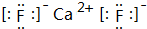 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M点和N点对应的溶液均呈中性 | |
| B. | T1℃时,P点对应溶液中,水电离出来的c(H+)可能为10-4mol•K-1或10-10mol•L-1 | |
| C. | T2℃时,pH=11的NaOH溶液与pH=1的稀H2SO4等体积混合,所得溶液的pH=6 | |
| D. | 向某溶液中加入酸或碱,均可以使该溶液从M点转化为N点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol 丙三醇和足量金属钠反应可以产生 3 mol H2 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色说明甲基对苯环性质有影响 | |
| C. | 丙烯的二氯代物有 5 种 | |
| D. | 芳香烃的通式是 CnH2n-6 (n≥6,n∈N) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 滤液I的主要成分是Na2SiO3、NaAlO2和NaOH | |
| B. | 滤液III的含大量的阴离子是HCO3- | |
| C. | 反应Y的离子方程式是2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 滤液II中通入过量的X的目的是使AlO2-充分沉淀而不引进杂质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com