
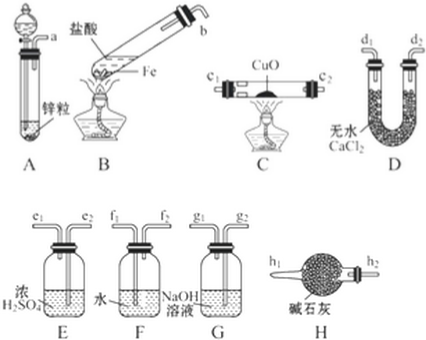
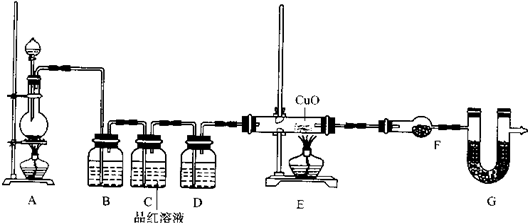
分析 根据实验目的需先制得氢气(选装置A),再除去氢气中混有的杂质HCl(选装置G)和水蒸气(选装置E),洗气时都是长管进短管出,然后氢气与CuO反应(选装置C),最后根据D装置中质量的变化得出实验过程中生成H2O的质量,进一步推算H2O的质量组成,为保证实验结果的严密性,应防止空气中的水蒸气进入D装置,需在D后接装置H,反应过程中玻璃管C的质量变化即CuO→Cu过程中的O的质量,为(w-m),氢元素的质量等于所得H2O的质量n g减去O的质量.虽然CuO部分被还原为Cu2O,但用于生成H2O的H、O两元素的质量比并不改变.
(1)先制得氢气(选装置A),再除去氢气中混有的杂质HCl(选装置G)和水蒸气(选装置E),洗气时都是长管进短管出,然后氢气与CuO反应(选装置C),最后根据D装置中质量的变化得出实验过程中生成H2O的质量,进一步推算H2O的质量组成,为保证实验结果的严密性,应防止空气中的水蒸气进入D装置,需在D后接装置H;
(2)实验装置里最后连接盛放碱石灰干燥管的目的是防止无水CaCl2吸收空气中水蒸气;
(3)实验目的是测定CD中固体质量的变化,先称量CD质量,再检查装置气密性,打开分液漏斗活塞,使盐酸和锌反应生成氢气,通过氧化铜完全反应后撤去酒精灯,待玻璃管冷却后再关闭活塞停止通氢,最后称量CD得到生成的水的质量和氧化铜反应前后的质量变化;
(4)反应过程中玻璃管C的质量变化即CuO→Cu过程中的O的质量,为(w-m),氢元素的质量等于所得H2O的质量n g减去O的质量;
(5)虽然CuO部分被还原为Cu2O,但用于生成H2O的H、O两元素的质量比并不改变.
解答 解:根据实验目的需先制得氢气(选装置A),再除去氢气中混有的杂质HCl(选装置G)和水蒸气(选装置E),洗气时都是长管进短管出,然后氢气与CuO反应(选装置C),最后根据D装置中质量的变化得出实验过程中生成H2O的质量,进一步推算H2O的质量组成,为保证实验结果的严密性,应防止空气中的水蒸气进入D装置,需在D后接装置H,反应过程中玻璃管C的质量变化即CuO→Cu过程中的O的质量,为(w-m),氢元素的质量等于所得H2O的质量n g减去O的质量.虽然CuO部分被还原为Cu2O,但用于生成H2O的H、O两元素的质量比并不改变.
(1)如果制得H2从左向右流向时,先制得氢气(选装置A),再除去氢气中混有的杂质HCl(选装置G)和水蒸气(选装置E),洗气时都是长管进短管出,然后氢气与CuO反应(选装置C),最后根据D装置中质量的变化得出实验过程中生成H2O的质量,进一步推算H2O的质量组成,为保证实验结果的严密性,应防止空气中的水蒸气进入D装置,需在D后接装置H,上述仪器的连接顺序是:a g2 g1 e2 e1 c2(或c1) c1(或c2) d1(或d2) d2(或d1) h2,
故答案为:a g2 g1 e2 e1 c2(或c1) c1(或c2) d1(或d2) d2(或d1) h2;
(2)实验装置里最后连接盛放碱石灰干燥管的目的是,防止无水CaCl2吸收空气中水蒸气,增大测定误差,
故答案为:防止无水CaCl2吸收空气中水蒸气,增大测定误差;
(3)实验目的是测定CD中固体质量的变化探究水的质量组成,先称量CD质量,再检查装置气密性,打开分液漏斗活塞,使盐酸和锌反应生成氢气,通过氧化铜完全反应后撤去酒精灯,待玻璃管冷却后再关闭活塞停止通氢,最后称量CD得到生成的水的质量和氧化铜反应前后的质量变化,正确操作的步骤是⑦、③、①、②、⑤、⑥、④、⑦,
故答案为:⑦、③、①、②、⑤、⑥、④、⑦;
(4)反应过程中玻璃管C的质量变化即CuO→Cu过程中的O的质量,为(w-m),氢元素的质量等于所得H2O的质量n g减去O的质量.虽然CuO部分被还原为Cu2O,但用于生成H2O的H、O两元素的质量比并不改变,所以水中氢、氧两元素的质量比可表示为:$\frac{n-(w-m)}{w-m}$,
故答案为:$\frac{n-(w-m)}{w-m}$;
(5)虽然CuO部分被还原为Cu2O,但用于生成H2O的H、O两元素的质量比并不改变,若实验中有部分CuO被还原为红色Cu2O,对实验的影响为无影响,
故答案为:无影响.
点评 本题考查了物质性质的实验探究、实验过程、实验装置连接、实验注意问题等,注意测定原理的理解应用,题目难度中等.


科目:高中化学 来源: 题型:实验题
| CaS04 | Mg2(OH)2C03 | CaC03 | BaS04 | BaC03 |
| 2.6×1 0-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×1 0-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食物放在冰箱中会减慢食物变质的速率 | |
| B. | 钾的金属性强,所以钾与水的反应比钠的反应剧烈 | |
| C. | 2mol SO2与1mol O2混合反应后一定能生成2 mol SO3 | |
| D. | 面粉厂严禁烟火的原因是面粉粉尘表面积大,与空气接触遇明火极易发生爆炸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 改变条件 | 平衡移动方向 | pH | 水电离出的c(H+) | KW |
| 升温 | ||||
| 通入HCl气体 | ||||
| 加入NaOH固体 | ||||
| 加入NH4Cl固体 | ||||
| 加入金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 假设 | 实验验证方法及现象 | |
| 假设1 | 白色浑浊物是BaSO3 | (1)在白色浑浊物中加入过量盐酸,会变澄清 |
假设2 | (2)白色浑浊物是BaSO4,主要 原因是Fe3+氧化了水中的SO2,在Ba2+作用下,生成BaSO4 | 反应开始前,先向制取SO2的装置中通入纯净的CO2,再把产生的SO2通入BaCl2溶液中,不出现浑浊.滴加FeCl3溶液后出现浑浊; (3)通入纯净的CO2的目的防止制备的SO2气体中混有空气(O2)对说明Fe3+氧化SO2造成干扰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 第二周期ⅣA族 第二周期ⅢA族 第七周期ⅣA族 | |
| B. | 第四周期ⅡA族 第二周期ⅢA族 第七周期ⅣA族 | |
| C. | 第二周期ⅣA族 第三周期ⅡA族 第四周期ⅦA族 | |
| D. | 第二周期ⅣA族 第三周期ⅡA族 第四周期ⅣA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com