
| A. | 若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解 | |
| B. | 若金属全部溶解,则溶液中一定含有Fe3+ | |
| C. | 若硝酸有剩余,溶液中可能含有Fe2+ | |
| D. | 若金属全部溶解,且产生336mL气体(标准状况下),则b=0.3 |
分析 A.溶液中有硝酸根时,再加入酸,溶液具有强氧化性,金属能溶解;
B.金属全部溶解,Fe可能以Fe2+形式存在;
C.硝酸有剩余,硝酸具有强氧化性,Fe2+具有还原性,两者不能共存;
D.若金属全部溶解,失去电子的是铁元素和铜元素,得电子的是硝酸中的氮元素,反应中硝酸起氧化剂、酸性作用,根据N元素守恒计算起氧化剂作用的硝酸的浓度,据此判断;
解答 解:A.若金属有剩余,溶液中有硝酸根,在溶液中再滴入硫酸后,相当于又存在了硝酸,金属均能溶解,故A正确;
B.当铁的量较多时,可以将生成的三价铁再还原为亚铁,溶液中不一定含有Fe3+,故B错误;
C.硝酸有剩余,硝酸具有强氧化性,Fe2+具有还原性,两者不能共存,所以不可能存在亚铁离子,故C错误;
D.硝酸中N元素的化合价由+5价到+2价,当产生336mL(标准状况),即0.015mol一氧化氮时,显示氧化性的硝酸为0.015mol,所以起氧化剂的硝酸的浓度c=$\frac{0.015mol}{0.05L}$=0.3mol/L,还有一部分硝酸显示了酸性,即b>0.3,故D错误;
故选A.
点评 本题考查氧化还原反应的计算、混合物计算,题目难度中等,注意物质氧化性、还原性的比较,比较容易.


科目:高中化学 来源: 题型:多选题
| A. | 化合物电离时,生成的阳离子是氢离子的是酸 | |
| B. | 化合物电离时,生成的阴离子是氢氧根离子的是碱 | |
| C. | 化合物电离时,生成金属阳离子和酸根离子的是盐 | |
| D. | NH4Cl是盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO+NO2+2NaOH=2NaNO2+H2O | B. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | ||
| C. | CuO+2HNO3═Cu(NO3)2+H2O | D. | 2FeCl2+Cl2=2FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
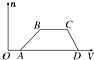 某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示.回答下列问题.
某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③⑤ | C. | ②③④ | D. | ①③④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com