
| A、H+是该反应的催化剂 |
| B、反应速率与c(H2O2)无关 |
| C、H2O是该反应的催化剂 |
| D、v(IO3-)=v(HSO3-)=v(HSO4-)=v(I-) |


科目:高中化学 来源: 题型:
| A、人体补充必需微量元素的最好方式是食用含微量元素添加剂的食品 |
| B、碳、氢、氧、氮、磷、氯、钠、钾等都是人体必需的常量元素 |
| C、青少年在生长发育阶段要注意补钙 |
| D、碘是公认的“智慧元素”,缺碘时易患甲状腺肿大病 |
查看答案和解析>>
科目:高中化学 来源: 题型:
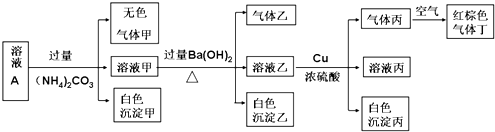
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 装置可用于蒸发氯化镁溶液得到无水氯化镁 |
B、 装置可用于铜和稀硝酸制取并收集少量NO |
C、 装置可用于证明铁生锈氧气参与反应 |
D、 苯萃取碘水中的碘后,从装置下口放出的是碘的苯溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制铁:以铁矿石为原料,在高温条件下用CO还原得到铁单质 |
| B、制镁:用海水为原料,经一系列过程制得氧化镁固体,电解熔融的氧化镁得到镁单质 |
| C、制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液得到金属钠 |
| D、制铝:从铝土矿中,经一系列反应得到氯化铝,电解熔融的氯化铝得到金属铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、N2(g)+3H2(g)?2NH3(g)△H<0 |
| B、H2(g)+CO(g)?C(s)+H2O(g)△H>0 |
| C、4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 |
| D、2SO3(g)?2SO2(g)+O2(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能自发进行的反应一定能迅速发生 |
| B、焓变或熵变均可以单独作为反应自发性的判据 |
| C、△H<0,△S>0的反应在温度低时不能自发进行 |
| D、NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)△H1=+185.57kJ?mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com