
【题目】2019年是元素周期表诞生150周年,目前周期表七个周期均已排满,共118种元素,如图是元素周期表短周期的一部分,下列说法中正确的是( )
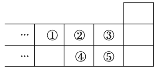
A. 元素①位于第二周期第ⅣA族
B. 气态氢化物的稳定性:④>②
C. 最高价氧化物对应水化物的酸性:⑤>④
D. 元素的最高正化合价:③=⑤
科目:高中化学 来源: 题型:
【题目】用铂电极电解100mLHNO3 与AgNO3 的混合液,通电一段时间后,两极均收集到4.48L气体(标准状况),则原混合液中Ag+的物质的量浓度为( )
A. 1mol·L-1B. 2mol·L-1C. 2.5mol·L-1D. 4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语或解释正确的是( )
A.碳酸的电离方程式:H2CO3![]() 2H++CO32-
2H++CO32-
B.少量二氧化硫通入氢氧化钠溶液中的化学方程式:SO2+NaOH=NaHSO3
C.碳酸氢钠溶液显碱性:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
D.向小苏打溶液中加入过量的石灰水:Ca2++OH-+HCO3-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求计算。
(1)0.5mol NaAlO2含有___mol Na+;_____mol AlO2-;含___个O。
(2)在100 mL 0.2 mol/L NaOH溶液中含溶质的物质的量___mol;配制50 mL 0.2 mol/LFeSO4溶液,需要FeSO4____ g。
(3)1.06 g的Na2CO3的物质的量是___mol;含有的CO32-离子数是___个。
(4)标准状况下,0.3 mol CH4的体积是___;含有碳原子质量是___;含有氢原子物质的量_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A.当它们的体积和温度、压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B.当它们的温度和密度都相同时,三种气体的压强:P(H2)>P(N2)>P(O2)
C.当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D.当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空:
(1)由CH4和O2组成的混合气体在标准状况下的密度为l g·L-1,则该混合气体中CH4和O2的体积比为________。
(2)用98%(密度为1.84g/mL )的浓硫酸配制500mL 2.5mol/L的稀硫酸,需用量筒量取浓硫酸的体积为________mL。
(3)向100mL 0.2mol/L 的NaAlO2溶液与300mL 0.1mol/L的HCl溶液混合,反应的离子方程式: _________________。
(4)某混合溶液中仅含有离子:Fe2+、Cl-、Br-、I-,测得Cl-、Br-、I-的物质的量之比为2:3:4,往溶液中通入一定量的氯气,充分反应后溶液中Cl-和Br-的物质的量之比为3:1,则通入的氯气的物质的量与溶液中剩余Fe2+的物质的量之比为=_________________。(假设溶液的体积在反应前后不变)
(5)酸性条件下,向FeI2的淀粉溶液中加入H2O2溶液后变蓝。当有1mol Fe2+被氧化成Fe3+时,转移电子4mol。写出该反应的离子方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,恒容密闭容器中发生反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O)(g),下列叙述不能说明该反应达平衡的是( )
4NO(g)+6H2O)(g),下列叙述不能说明该反应达平衡的是( )
A.V(正)(O2)=![]() V(逆)(NO)B.密闭容器内气体的密度不再改变
V(逆)(NO)B.密闭容器内气体的密度不再改变
C.密闭容器的压强不变D.氮气的浓度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成水煤气,化学反应方程式为___。
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
①合成氨的反应中的能量变化如图所示。该反应是___反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量___(填“大于”或“小于”)生成物化学键形成放出的总能量。

②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是____(填序号)。
A.容器中N2、H2、NH3共存 B.N2、NH3浓度相等
C.N2、H2、NH3的物质的量之比为1:3:2 D.容器中的压强不随时间变化
(3)工业上用电解饱和食盐水的方法制取氯气、烧碱和氢气。其化学反应方程式为____。用氯气和烧碱可进一步反应,制得消毒液,反应的离子方程式为___。
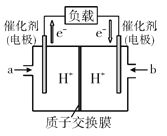
(4)如图是某笔记本电脑使用的甲醇空气燃料电池的结构示意图。放电时甲醇应从__处通入(填“a”或“b”),电池内部H+向__(填“左”或“右”)移动,写出负极的电极反应式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素对肿瘤细胞的杀伤有独特作用,其结构如图所示,下列有关叙述正确的是( )
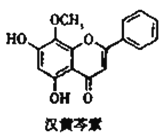
A. 汉黄芩素的分子式为C16H14O5
B. 1mol该物质与NaOH溶液反应,可消耗2molNaOH
C. 1mol该物质与溴水反应,最多消耗1molBr2
D. 该物质可发生取代、加成、缩聚、消去反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com