
分析 A、B、C、D、E都是短周期元素,原子序数依次增大,A原子的最外层电子数比次外层电子层多3个,原子只能有2个电子层,最外层电子数为5,故A为N元素;E是地壳中含量最高的金属元素,则E为Al;A、B处于同一周期,C、D、E同处另一周期,则C为Na、D为Mg;C、B可按原子个数比2:1和1:1分别形成两种离子化合物甲和乙,则B为O,甲为Na2O、乙为Na2O2,据此解答.
解答 解:A、B、C、D、E都是短周期元素,原子序数依次增大,A原子的最外层电子数比次外层电子层多3个,原子只能有2个电子层,最外层电子数为5,故A为N元素;E是地壳中含量最高的金属元素,则E为Al;A、B处于同一周期,C、D、E同处另一周期,则C为Na、D为Mg;C、B可按原子个数比2:1和1:1分别形成两种离子化合物甲和乙,则B为O,甲为Na2O、乙为Na2O2.
(1)D为Al元素,在周期表中的位置是:第三周期ⅢA族,A为N元素,最高正化合价为+5,最高价氧化物的化学式是:N2O5,
故答案为:第三周期ⅢA族;N2O5;
(2)同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:O<N<Al<Mg<Na,
故答案为:O<N<Al<Mg<Na;
(3)E的最高价氧化物对应的水化物为Al(OH)3、C的最高价氧化物对应的水化物为NaOH,而发生反应的化学方程式是:Al(OH)3+NaOH=NaAlO2+2H2O,
故答案为:Al(OH)3+NaOH=NaAlO2+2H2O;
(4)根据金属与热水的反应可确定金属的活泼性,则设计实验为:镁与热水可以反应生成氢氧化镁和氢气,但铝和热水不反应,
故答案为:镁与热水可以反应生成氢氧化镁和氢气,但铝和热水不反应.
点评 本题考查位置结构性质关系,明确元素的推断是解答本题的关键,题目难度不大,注意掌握金属性、非金属性强弱比较事实.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 试管中加入少量苯,加入溴水振荡后,溴水褪色,发生了加成反应 | |
| B. | 苯能使酸性高锰酸钾溶液褪色 | |
| C. | 苯较难发生加成反应,所以通常要加入催化剂 | |
| D. | 苯不能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c (Ba2+)=c(SO42-)=(Ksp)${\;}^{\frac{1}{2}}$ | B. | c(Ba2+)•c(SO42-)>Ksp,c(Ba2+)=c(SO42-) | ||
| C. | c(Ba2+)•c(SO42-)=Ksp,c(Ba2+)>c(SO42-) | D. | c(Ba2+)•c(SO42-)≠Ksp,c(Ba2+)<c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
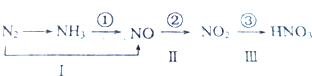
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
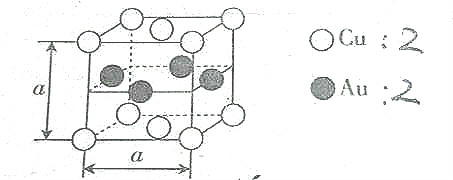
| A. | 该合金属于离子晶体 | B. | 该合金中Au的配位数是4 | ||
| C. | 该合金中Cu的配位数是8, | D. | 该合金的硬度低于Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
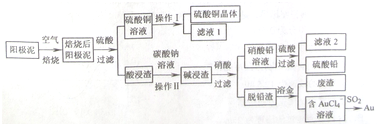
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当容器中X与Y的物质的量浓度之比满足1:2时,反应达到平衡 | |
| B. | 达到平衡后,反应速率3v正(Y)=2v逆(z) | |
| C. | 达到平衡时,X的转化率为25%,则平衡常数K值为$\frac{1}{16}$ | |
| D. | 达到平衡后,升高温度,X的体积分数增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com