
实验室要用CuSO4·5H2O晶体配制500 mL 0.1 mol·L-1 CuSO4溶液,回答下列问题:
(1)应该用托盘天平称取CuSO4·5H2O________g。
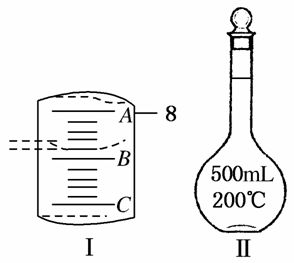
(2)如图Ⅰ表示10 mL量筒中液面的位置,A与B,B与C刻度间相差1 mL,如果刻度A为8,量筒中液体的体积是________mL。
(3)若实验中如图Ⅱ所示的仪器有下列情况,对配制溶液的浓度有何影响?(填“偏高”“偏低”或“无影响”)
A.定容前容量瓶底部有水珠__________________________;
B.定容时加水超过刻度线____________________________;
C.最终定容时俯视观察液面__________________________。
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均 匀,测得混合液最高温度
匀,测得混合液最高温度 。回答下列问题:
。回答下列问题:
(1)为什么所用NaOH溶液要稍过量?__________________
________________________________________________________。
(2)倒入NaOH溶液的正确操作是__________(填序号)。
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为________________。
(5)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为 了计算中和热,某学生实验记录数据如下:
了计算中和热,某学生实验记录数据如下:
| 实验序号 |
| 终止温度t2/ ℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=__________(结果保留一位小数)。
(6)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某蛋白质含N的质量分数为15%,若成年人每天排出尿素25 g,则他每天从食物中摄取的蛋白质的质量平均为( )
A.77.8 g B.66.9 g
C.90.7 g D.106 g
查看答案和解析>>
科目:高中化学 来源: 题型:
有NO、CO2、N2O4三种气体,它们分别都含有0.5 mol氧原子,则三种气体的物质的量之比为( )
A.1:2:4 B.1:1:1
C.4:2:1 D.1:2:4
查看答案和解析>>
科目:高中化学 来源: 题型:
200 mL 0.3 mol/L的K2SO4溶液和100 mL 0.2 mol/L的Fe2(SO4)3溶液混合后(不考虑混合后溶液体积的变化),溶液中SO 的物质的量浓度为( )
的物质的量浓度为( )
A.0.3 mol/L B.0.4 mol/L
C.0.45 mol/L D.0.5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
如何从石油中获得更多的轻质燃油一直是化学家探索的课题,将石油分馏得到的重油进行裂
化可以获得更多的轻质燃油。
资料一:石蜡是含有20~30个碳原子的烷烃的混合物,常温下呈固态。
资料二:石油催化 裂化中通常使用Al2O3作催化剂。
裂化中通常使用Al2O3作催化剂。
某研究性 学习小组在实验室中模拟石油的催化裂化,装置如图:实验过程中可观察到烧瓶Ⅰ中固体石蜡先熔化,试管Ⅱ中有少量液体凝结,试管Ⅲ中酸性高锰酸钾溶液褪色,实验后闻试管Ⅱ中液体气味,具有汽油的气味。
学习小组在实验室中模拟石油的催化裂化,装置如图:实验过程中可观察到烧瓶Ⅰ中固体石蜡先熔化,试管Ⅱ中有少量液体凝结,试管Ⅲ中酸性高锰酸钾溶液褪色,实验后闻试管Ⅱ中液体气味,具有汽油的气味。
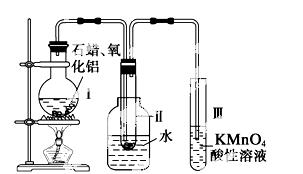

(1)该装置仪器连接的顺序应遵循的原则为__________________________________,为保证实验成功,实验前必须进行的操作是__________________________________,装置中较长导管的作用是______________;
(2)试管Ⅱ中有 少量液体凝结说明了_____________;
少量液体凝结说明了_____________;
(3)试管Ⅲ中溶液褪色说明了___________________;
(4)能否用试管Ⅱ中的液体萃取溴水中的溴,理由是_________________________________________。
(5)写出二十烷裂化得到癸烷和癸烯的化学方程式___________________________。
(6) 石油裂化的重要意义是__________________。
石油裂化的重要意义是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
“绿色汽车”是指使用液化石油等无污染或污染小的能源作燃料的汽车,可有效减少有毒的铅、苯的同系物以及稠环芳烃的排放。燃烧等质量的液化石油气(主要成分是含C3~C4的烃)与汽油比较,最突出的优点是( )
A.前者生成的水少
B.前者消耗氧气量少
C.前者燃烧产生的热量多
D.前者对环境的污染小
查看答案和解析>>
科目:高中化学 来源: 题型:
20世纪90年代初,国际上提出了“预防污染”这一新概念。绿色化学是“预防污染”的根本手段,它的目
标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各个环节中都实现净化和
无污染。
(1)下列各项属于“绿色化学”要求的是________。
A.处理废弃物 B.治理污染点
C.减少有毒物 D.杜绝污染源
(2)在我国西部大开发中,某省为筹建一大型化工基地,征集到下列方案,其中你认为可行的是____。
A.建在西部干旱区可以脱贫致富
B.应建在水资源丰富和交通方便且远离城市的郊区
C.企业有权自主选 择厂址
择厂址
D.不宜建在人口稠密的居民区
(3)某化工厂排放的污水中含有Mg2+、Fe3+、C u2+、Hg2+四种离子。甲、乙、丙三位学生分别设计了从该污水中回收纯净的金属铜的方案。
u2+、Hg2+四种离子。甲、乙、丙三位学生分别设计了从该污水中回收纯净的金属铜的方案。
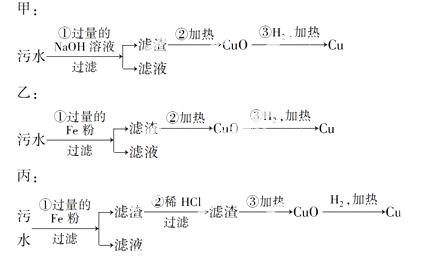
在能制得纯铜的方案中,哪一步操作会导致环境污染?________________。应增加哪些措施防止污染?____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
按下图所示装置进行实验,并回答下列问题:
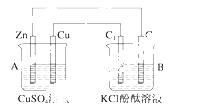
(1)判断装置的名称:A池为________,B池为______。
(2)锌极为______极,电极反应式为____________________________________;
铜极为______极,电极反应式为______________________________________;
石墨棒C1为____极,电极反应式为___________________________________;
石墨棒C2附近发生的实验现象为_____________________________________。
(3)当C2极析出224 mL气体(标准状况)时,锌的质量________(填“增加”或“减少”)______g,CuSO4溶液的质量________(填“增加”或“减少”)________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com