
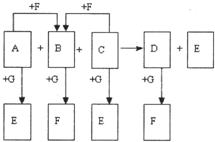
 已知图中所有物质均为化合物,A、C的水溶液呈碱性,且C是一种强碱,F、G的水溶液呈酸性.B为红褐色沉淀,化合物G在常温下呈气态,其水溶液是一种常见的强酸,A、C、D、E焰色反应呈黄色.A、D的水溶液都有杀菌消毒作用. A、B、C反应时,物质的量之比为3:2:4.其它物质相互间的转化关系如图所示(各反应在常温下即可发生;多数反应的生成物没有写完整).请写出:
已知图中所有物质均为化合物,A、C的水溶液呈碱性,且C是一种强碱,F、G的水溶液呈酸性.B为红褐色沉淀,化合物G在常温下呈气态,其水溶液是一种常见的强酸,A、C、D、E焰色反应呈黄色.A、D的水溶液都有杀菌消毒作用. A、B、C反应时,物质的量之比为3:2:4.其它物质相互间的转化关系如图所示(各反应在常温下即可发生;多数反应的生成物没有写完整).请写出: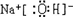 ;
;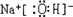 ;
;

 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
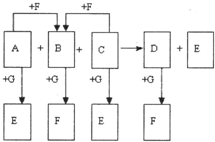 (2010?金华模拟)已知图中所有物质均为化合物,A、C的水溶液呈碱性,且C是一种强碱,F、G的水溶液呈酸性.B为红褐色沉淀,化合物G在常温下呈气态,其水溶液是一种常见的强酸,A、C、D、E焰色反应呈黄色.A、D的水溶液都有杀菌消毒作用. A、B、C反应时,物质的量之比为3:2:4.其它物质相互间的转化关系如图所示(各反应在常温下即可发生;多数反应的生成物没有写完整).请写出:
(2010?金华模拟)已知图中所有物质均为化合物,A、C的水溶液呈碱性,且C是一种强碱,F、G的水溶液呈酸性.B为红褐色沉淀,化合物G在常温下呈气态,其水溶液是一种常见的强酸,A、C、D、E焰色反应呈黄色.A、D的水溶液都有杀菌消毒作用. A、B、C反应时,物质的量之比为3:2:4.其它物质相互间的转化关系如图所示(各反应在常温下即可发生;多数反应的生成物没有写完整).请写出: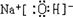
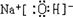
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
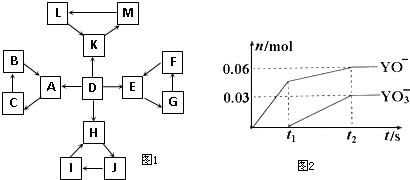
| 编号 | 信 息 |
| 1 | D为地壳中含量最高的元素组成的单质 |
| 2 | E为酸性氧化物,不溶于水,能与某种酸反应 |
| 3 | F不溶于水,F用于制备干燥剂以及催化剂的载体 |
| 4 | H为淡黄色固体化合物 |
| 5 | 电解饱和J溶液是工业生产中的重要反应 |
| 6 | C为离子化合物,阴、阳离子均含有金属元素 |
| 7 | K为酸雨的主要成分 |
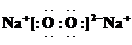
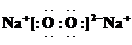
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)下图中所有物质均为中学化学常见物质,F、H是气体单质,Z是金属单质,Y中阳离子与阴离子个数比为2 :1,化合物X、Y、A、D、E、G的焰色反应均为黄色,I是白色胶状沉淀。
请回答下列问题:
(1)Y的电子式 。关于Y的说法正确的是 。
A.Y是酸性氧化物 B. Y是过氧化物 C. Y是碱性氧化物 D. Y可以作漂白剂
(2)J溶液中离子浓度由大到小的顺序为_____________________________________________。
(3)写出G与盐酸反应生成I的离子方程式 。
(4)写出B与Y反应的化学方程式 。
(5)将一定量的黄绿色气体W2通入到E的溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含W元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化如图所示。该反应中转移电子的物质的量是 mol,该反应总反应的化学方程式为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)已知右图中所有物质均为化合物,A、 C的水溶液呈碱性,且C是一种强碱,F、G的水溶液呈酸性。B为红褐色沉淀,化合物G在常温下呈气态,其水溶液是一种常见的强酸,A、C、D、E焰色反应呈黄色。A、D的水溶液都有杀菌消毒作用。 A、B、C反应时,物质的量之比为3:2:4。其它物质相互间的转化关系如图所示(各反应在常温下即可发生;多数反应的生成物没有写完整)。请写出:
(1)A的化学式_____________,C的电子式:_________________;
(2)A、B、C三者发生反应的离子方程式:__________________________
(3)已知D和G反应时还有使带火星的木条复燃的气体产生,则D和G反应的化学方程式为:_ _。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com