
【题目】铅的单质、氧化物、盐在现代工业中有着重要用途。
Ⅰ.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、类似Fe3O4的Pb3O4,Pb3O4与HNO3发生非氧化还原反应生成一种盐和一种铅氧化物,其反应的化学方程式为_____________。
Ⅱ.以含铅废料(主要含Pb、PbO、PbO2、PbSO4)为原料制备高纯PbO,其主要流程如下:

(2) “酸溶”时,在Fe2+催化下,Pb和PbO2反应生成PbSO4生成1molPbSO4转移电子的物质的量为____________mol。
(3)已知:①PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq),其溶解度曲线如图所示:
NaHPbO2(aq),其溶解度曲线如图所示:

②粗品PbO中所含杂质不溶于NaOH溶液。
结合上述信息,完成由粗品PbO得到高纯PbO的操作:将粗品PbO溶解在一定量__________(填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,___________(填“趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(4)将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl2的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。

①阴极的电极反应式为_______________________。
②电解一段时间后,Na2PbCl4浓度极大减小,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是_________________________。
【答案】 Pb3O4+ 4HNO3=2Pb(NO3)2+PbO2+2H2O 1 35% 趁热过滤 PbCl42-+2e-=Pb+4Cl- 继续向阴极区加PbO粗品
【解析】I.(1).由题目信息可知Pb3O4中铅的化合价为+2、+4两种价态,组成相当于2PbOPbO2,由于PbO2是酸性氧化物,故它不能与硝酸反应,PbO是碱性氧化物,它与硝酸发生非氧化还原反应,生成Pb(NO3)2,由此可写出对应的化学方程式:Pb3O4+ 4HNO3=2Pb(NO3)2+PbO2+2H2O,故答案为:Pb3O4+ 4HNO3=2Pb(NO3)2+PbO2+2H2O;
II. (2).“酸溶”时,在Fe2+催化下,Pb和PbO2反应生成PbSO4和水,反应方程式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,根据方程式中Pb元素的化合价变化可知,每生成2mol PbSO4,转移电子2mol,则生成1molPbSO4转移电子的物质的量为1mol,故答案为:1;
(3).根据PbO的溶解度曲线特点可知,在浓度高的NaOH溶液及较高的温度下,PbO的溶解度大,因此将粗品PbO溶解在一定量35%的NaOH 溶液中,加热至110℃,充分溶解后,在高温下趁热过滤除去杂质,将滤液冷却结晶,过滤、洗涤并干燥即可得到高纯PbO 固体,故答案为:35%;趁热过滤;
(4). ①.根据电化学原理可知,阴极发生还原反应,则Na2PbCl2得到电子生成Pb,电极反应式为:PbCl42-+2e-=Pb+4Cl-,故答案为:PbCl42-+2e-=Pb+4Cl-;
②. 阴极发生还原反应,则Na2PbCl2得到电子生成Pb,电极反应式为:PbCl42-+2e-=Pb+4Cl-,阳极发生氧化反应,溶液中的H2O放电生成氧气和氢离子,电极反应式为:2H2O-4e-=O2+4H+,电解一段时间后,Na2PbCl2的浓度极大减小,为了恢复其浓度且实现物质的循环利用,根据少什么加什么的原则,溶液中减少了Pb和O,应该在阴极区加PbO粗品,故答案是:继续向阴极区加PbO粗品。


科目:高中化学 来源: 题型:
【题目】在一定条件下,A、B反应生成C和D,在2L的密闭容器中进行,起始时加入了4molA和2molB,经过一段时间达到反应限度,测得C的浓度为1mol/L,D的平均反应速率为0.2 mol·L-·min-,A与B都反应了50%,且D与A的化学计量数相同,请回答下列问题:
(1)达到反应限度这段时间内A的反应速率为______________。
(2)写出该反应的化学方程式:________________________________。
(3)达到化学反应限度所用的时间为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图装置,研究非金属元素性质变化规律。

已知:高锰酸钾在常温下与浓盐酸反应产生氯气。
(1)利用如图装置证明Cl2氧化性强于I2的氧化性。则A中装浓盐酸,B中装入高锰酸钾粉末, C中装入淀粉KI溶液,则C中现象是___________________________
(2)如果C中装饱和的H2S溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀,证明硫的非金属性比氯的非金属性________(填“强”或“弱”或“无法判断”)。
(3)现有浓硝酸、大理石、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:非金属性:N > C > Si。C中装试剂________________,实验现象为_________________________该装置存在不足之处,改进措施为:______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。
(1)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃。
① 甲硅烷(SiH4)固态时属于___________晶体。
② 已知室温下1 g甲硅烷自燃生成SiO2和液态水放出热量44.6 kJ,则其热化学方程式为______________________。
(2)甲醇燃料电池的总反应为:2CH3OH+3O2═2CO2↑+4H2O,其工作原理如下图所示。
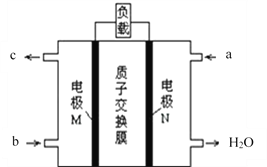
①图中CH3OH从_____________(填a或b)通入,该电池的正极是____________(填M或N)电极,其中在N极发生的电极反应式是_____________________。
②如果在外电路中有1mol电子转移,则消耗标准状况下O2的体积为_______L。
(3)25℃,101kPa条件下,14g N2和3g H2反应生成NH3的能量变化如下图所示:

已知:① x = 1127;
② 25℃ 101kPa下,N2(g)+3H2(g)![]() 2NH3(g)△H=-92kJ·mol—1。
2NH3(g)△H=-92kJ·mol—1。
则 y =__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1molH-H要吸收的能量为436kJ,形成1molH-N放出391kJ的能量,氨气的结构如图,根据化学方程式N2+3H2 ![]() 2NH3,1molN2与3molH2反应时放热92kJ,则断裂1molN≡N所需要的能量为 ( )
2NH3,1molN2与3molH2反应时放热92kJ,则断裂1molN≡N所需要的能量为 ( )

A. 431kJ B. 698kJ C. 946kJ D. 394kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C的简单离子和B的简单离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物中阴阳离子的个数比为1:1。根据判断出的元素及相应化学式回答问题:
(1)五种元素中,金属性最强的是_______(填元素名称),非金属性最强的元素是_____(填元素名称)。
(2)由元素A分别和元素B、D、E所形成的共价型化合物中,热稳定性最差的是________________________________________(用化学式表示)。
(3)元素A和E形成的化合物与元素A和B形成的化合物反应,产物的电子式为____________,其中存在的化学键类型为_________________________。
(4)E离子的结构示意图是_______________。单质E与水反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列框图关系填空,已知反应①、③是我国工业生产中的重要反应,X常温下为无色无味透明液体;C焰色反应火焰呈黄色,J为红褐色沉淀;D、E常温下为气体,且E能使品红溶液褪色;A固体中仅含两种元素,其中金属元素的质量分数约为46.7%. 
(1)A的化学式为; F的化学式为;
(2)反应③的化学方程式:;
(3)反应②的离子方程式:;
(4)反应④的离子方程式:;
(5)已知每生成16g E,放出106.5kJ热量,则反应①的热化学方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液体积比是( )
A.1:9
B.1:1
C.1:2
D.1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com