
| 物质 | X | T | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A、反应达到平衡时,X的转化率为50% |
| B、反应可表示为X+3Y?2Z,其平衡常数为1600(mol/L)-2 |
| C、改变温度可以改变此反应的平衡常数 |
| D、增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| 转化量 |
| 初始量 |
| 0.1mol/L-0.05mol/L |
| 0.1mol/L |
| C2(Z) |
| C(X)C 3(Y) |
| (0.1mol/L) 2 |
| (O.O5mol/L)×(0.05mol/L) 3 |


科目:高中化学 来源: 题型:
| A、181:209 | B、28:44 |
| C、1:2 | D、1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
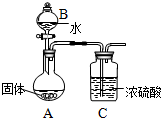 镁在空气中燃烧除生成MgO外,还可能生成Mg3N2.某校化学兴趣小组的同学利用镁在空气中燃烧后的固体(不含单质)进行实验,探究其组成.
镁在空气中燃烧除生成MgO外,还可能生成Mg3N2.某校化学兴趣小组的同学利用镁在空气中燃烧后的固体(不含单质)进行实验,探究其组成.查看答案和解析>>
科目:高中化学 来源: 题型:
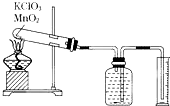 某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.
某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16.7% | B、50% |
| C、66.7% | D、83.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:
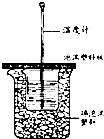 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 加BaCl2溶液 |
| 加足量稀盐酸 |
| 加Ba(NO3)2溶液 |
| 加足量稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com