
| A. | 在25℃和80℃时纯水中的c(H+)浓度 | |
| B. | 室温时,浓度均为 0.1mol/L的(NH4)2SO4(aq)、(NH4)2CO3 (aq)的c(NH4+) | |
| C. | 25℃时,pH均为3的HCl和NH4Cl溶液中水的电离程度 | |
| D. | 1 L饱和氯化铵溶液中NH4+ 和Cl- 的个数 |
分析 A.水的电离吸热;
B.(NH4)2CO3 (aq)中铵根离子与碳酸根离子相互促进水解;
C.HCl和NH4Cl中氢离子浓度相同,均抑制水的电离;
D.NH4+水解.
解答 解:A.水的电离吸热,则在25℃和80℃时纯水中的c(H+)浓度为前者小于后者,故A不选;
B.(NH4)2CO3 (aq)中铵根离子与碳酸根离子相互促进水解,则铵根离子浓度较小,可知室温时,浓度均为 0.1mol/L的(NH4)2SO4(aq)、(NH4)2CO3 (aq)的c(NH4+)为前者大于后者,故B选;
C.HCl和NH4Cl中氢离子浓度相同,均抑制水的电离,则水的电离程度相同,故C不选;
D.NH4+水解,则1 L饱和氯化铵溶液中NH4+ 和Cl- 的个数为前者小于后者,故D不选;
故选B.
点评 本题考查离子浓度大小的比较,为高频考点,把握水的电离、盐类水解等为解答的关键,侧重分析与应用能力的考查,注意选项B中相互促进水解的判断,题目难度不大.


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2溶液与足量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O | |
| B. | 等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| C. | 向100mL 1mol/L FeBr2溶液中通入0.5mol Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| D. | 向澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
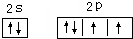 ;
;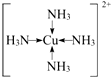 (用元素符号表示).
(用元素符号表示).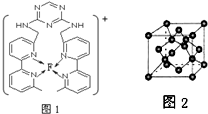
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3是医用的胃酸中和剂的一种 | |
| B. | 铁的氧化物都不溶于水,但可与水反应 | |
| C. | 铁容易形成致密的氧化膜,抗腐蚀性能好 | |
| D. | 取一片铝条放在酒精灯上加热至熔化,铝会滴落下来 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
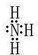 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
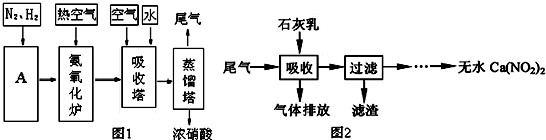
 CO+3H2.
CO+3H2.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | MgSO4的溶解度随温度升高而升高 | |
| B. | NaCl的溶解度比MgSO4的溶解度大 | |
| C. | 在t2℃时,MgSO4饱和溶液的溶质质量分数最大 | |
| D. | 把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
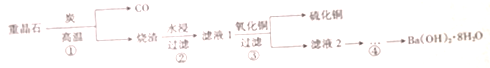
| A. | 步骤①中BaSO4作氧化剂 | |
| B. | 步骤②所得滤液1呈中性 | |
| C. | 步骤③中发生复分解反应 | |
| D. | 步骤④的实验操作中不需要用到石棉网、坩埚 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com