
| A. | 0.l mol•L-1醋酸钙溶液中,c(Ca2+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 等体积等pH的NH4Cl溶液、盐酸,完全溶解少量且等同的锌粉,前者用时少 | |
| C. | 将n mol H2(g)、n mol I2(g)和2n mol H2 (g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 | |
| D. | 某物质的溶液中由水电离出的c(H+)=1×10-a mol•L-1,若a>7时,则该溶液的pH一定为14-a |
分析 A.醋酸根离子的水解程度较小,则c(CH3COO-)>c(Ca2+);
B.铵根离子在溶液中存在水解平衡,则消耗等量的锌粉时消耗的氯化铵的量小于盐酸;
C.恒温恒容仪器中,两个反应为等效平衡,则两个反应中氢气的转化率相等;
D.常温时,某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液.
解答 解:A.醋酸钙溶液中,由于醋酸根离子的水解程度程度较小c(CH3COO-)>c(Ca2+),溶液中正确的离子浓度大小为:c(CH3COO-)>c(Ca2+)>c(OH-)>c(H+),故A错误;
B.等体积等pH的NH4Cl溶液、盐酸,由于铵根离子存在水解平衡,当溶液中氢离子浓度减小时铵根离子的水解程度增大,则完全溶解少量且等同的锌粉,消耗的氯化铵的量小于盐酸,故B正确;
C.将n mol H2(g)、n mol I2(g)和2n mol H2 (g)、2n mol I2(g)分别充入两个恒温恒容的容器中,两个反应为等效平衡,则达到平衡时氢气的转化率相同,故C错误;
D.常温时,某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液,如为酸溶液,则pH=14-a,如为碱溶液,则pH=a,故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及电荷守恒、物料守恒的含义为解答关键,注意掌握判断离子浓度大小常用方法,试题充分考查了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
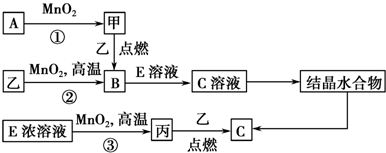
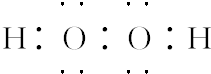 .若反应①需在加热条件下进行,则反应①的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
.若反应①需在加热条件下进行,则反应①的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙烷和乙酸都可以与钠反应生成氢气 | |
| B. | 组成人体蛋白质的氨基酸有必须和非必须之分 | |
| C. | 乙醇和乙酸都是厨房中常用的调味品 | |
| D. | 淀粉和纤维素的组成都是(C6H10O5)n,水解最终产物都是葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式可以表示为CH2CH2 | |
| B. | 石油裂解可以得到氯乙烯 | |
| C. | 丙烯转化为聚丙烯符合绿色化学原子经济性要求 | |
| D. | 油脂都不能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com